来源:
TMB(肿瘤突变负荷),一个肿瘤免疫治疗时代孕育而出的“苦命”娃,从2014年呱呱坠地开始,便命途多舛。2018年写入肺癌NCCN指南后迎来了人生的首个“巅峰”,可好景不长,2019年的WCLC和ESMO(KN021,KN189,CM227等)便让其连遭打击,差点“夭折”。但TMB还年轻,不服输不言弃的坚持使它得到了部分“贵人”(KN042,KN010,KN158等)的相助,“贵人”表示,TMB在免疫联合方面的预测性较差,但在免疫单药治疗疗效方面的预测还是可行,应辩证看待TMB的“成长”。
TMB究竟还能不能重返巅峰?这是很多人心中的疑问。
经历了2019的风雨洗礼,TMB终于在2020见到了绚丽的彩虹。2020年4月7日,FDA基于II期KN158数据授予Keytruda单药治疗 tTMB-H(组织TMB≥10个突变/Mb)且既往治疗后疾病进展的不可手术或转移性的成人和儿童实体瘤患者的优先审评资格。一旦获批,TMB将成为继MSI/dMMR后第二个泛癌种免疫治疗伴随诊断标志物,TMB离重返巅峰之路又近了一步。
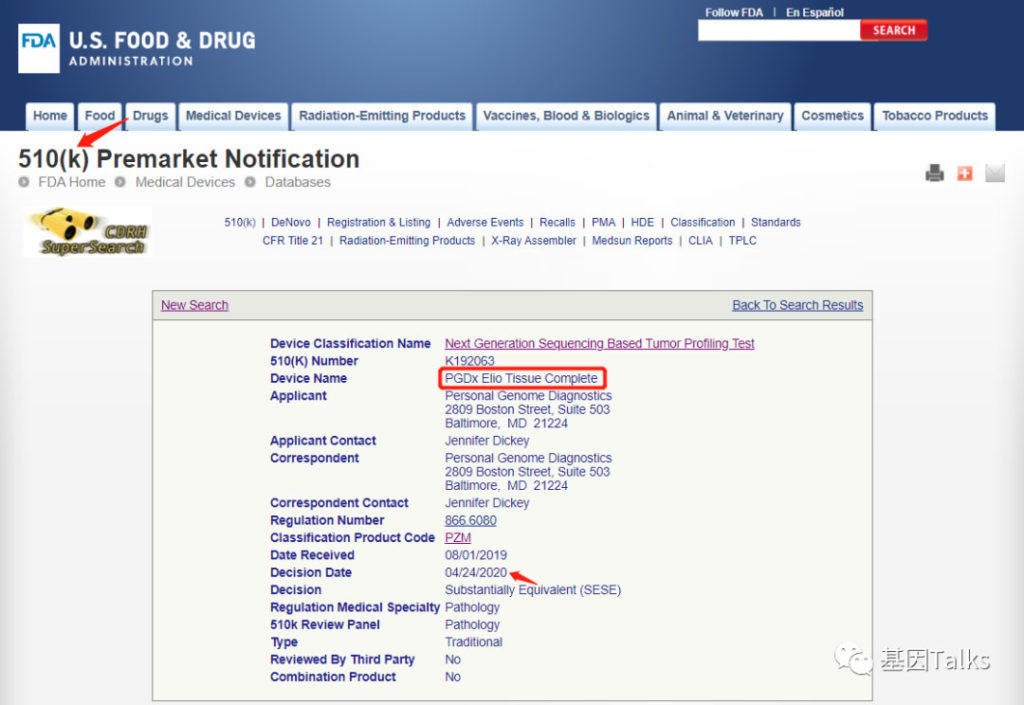
2020年4月24日,美国FDA又批准了一款肿瘤NGS大panel产品 PGDx Elio Tissue Complete 的510(K)上市申请,该产品可同时检测507个基因的体细胞变异,包括MSI和TMB,这再次证明了TMB检测的重要性。
借用2020年爆火的歌曲《少年》来评价此时的TMB最为合适不过:你还是从前那个少年,没有一丝丝改变,时间只不过是考验,种在心中信念丝毫未减,眼前这个少年,还是最初那张脸,面前再多艰险不退却……
TMB的检测,目前的建议是使用超过300基因的 NGS 大panel进行检测(覆盖率大于 0.8 MB,最好大于 1.0 MB),确保报告TMB的准确性(基因数量、捕获区域、胚系过滤、突变类型、突变阈值和测序深度)。
此前,2017年 FDA批准(FDA-approved,三类)的 F1CDx(324基因,全长2.2Mb,CDS区约0.8Mb)和 2019年 FDA认证(FDA-cleared,二类)的 Omics Core(19,396基因,全长39Mb,CDS区约33.7Mb)两款产品都是可以检测TMB的。(FDA认证的MSK-IMPACT预期用途尚不包括TMB的检测,虽然文献中有过TMB研究报道,468基因,全长1.53Mb,CDS区约1.14Mb)
2020年4月24日,美国FDA再下一城,批准了 Personal Genome Diagnostics 公司的 PGDx Elio Tissue Complete 产品的510(K)上市申请。PGDx Elio Tissue Complete 是 FDA认证(FDA-cleared)的一款肿瘤NGS大panel产品(507基因,全长2.23Mb,CDS区约1.33Mb),可检测癌症组织中507个癌症相关基因的 SNVs,Indels,CNVs 及 Rearrangements,以及包括MSI和TMB在内的基因组特征生物标志物。此次批准再次证明了TMB检测的重要性。
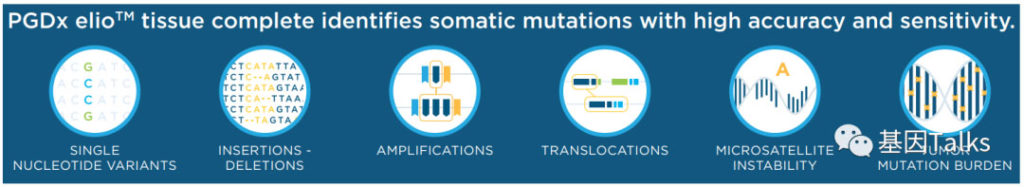
据PGDx官网消息称,PGDx Elio Tissue Complete 是业内首个也是唯一一个获FDA认证用于肿瘤基因检测+自动化生信分析出报告为一体的NGS诊断试剂盒(综合基因组诊断试剂盒),可在全国各地的实验室使用。该试剂盒以更有效,可靠和准确的方式进行癌症的基因组分析,进而帮助临床医生选择合适的靶向药物或免疫药物,或帮助患者入组临床试验。
详细了解此款NGS大panel
① 设备名称:PGDx Elio Tissue Complete
② 设备分类:Next Generation Sequencing Based Tumor Profiling Test(基于NGS的肿瘤分析检测)
③ 510(K)编号:K192063,与同类产品做了510(K)实质性等同(Substantially Equivalent (SESE))对比而获批(猜测可能是与SMK-IMPACT对比,具体等官方公布)
④ FDA分类:CLASS II(II类)
⑤ 产品归属:Pathology(病理)
⑥ 预期用途:一种定性检测的IVD产品,采用NGS方法对来自实体恶性肿瘤患者的福尔马林固定石蜡包埋(FFPE)的肿瘤组织DNA与正常标本或外周血DNA进行多基因对照检测分析,检测分析内容包括 SNVs,Indels,CNVs 及 Rearrangements,以及MSI和TMB。
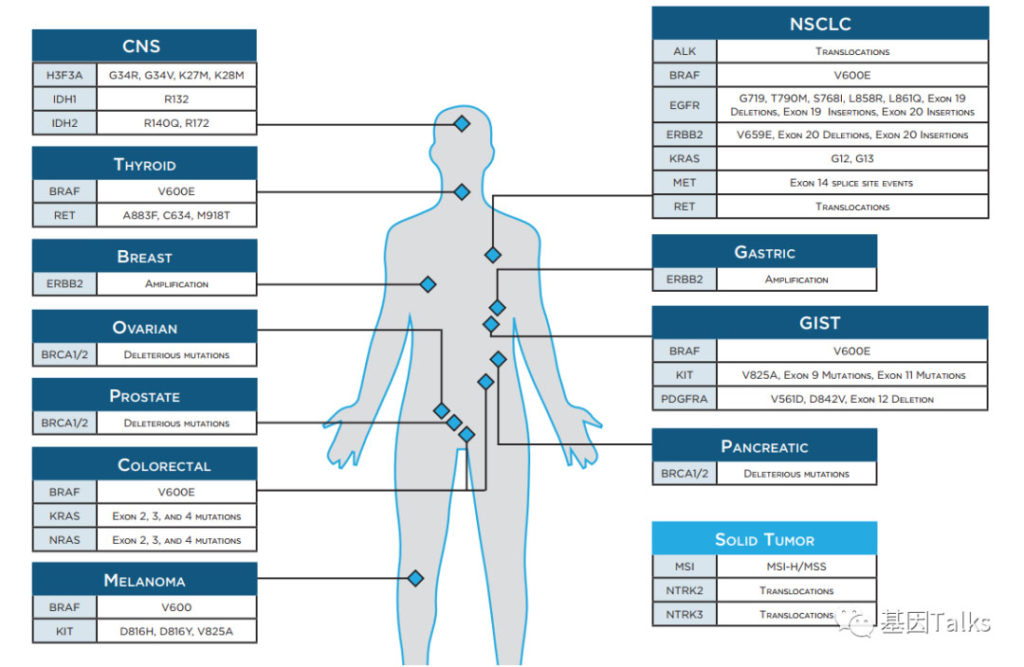
⑦ 检测基因:507基因(包括NCCN指南所有癌种在内的所有基因)的全部外显子区域及部分非编码区,特异性分析HER2基因扩增及ALK,RET,NTRK1/2的融合等。(注:最新文献资料显示是507基因,与以往市场资料可能有出入)
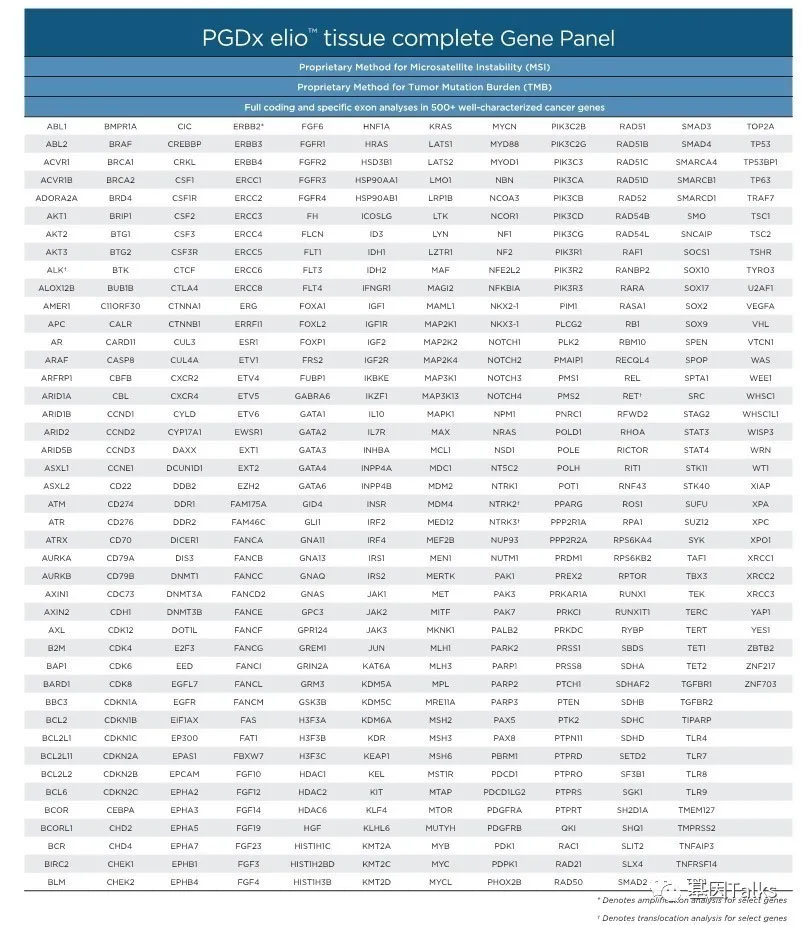
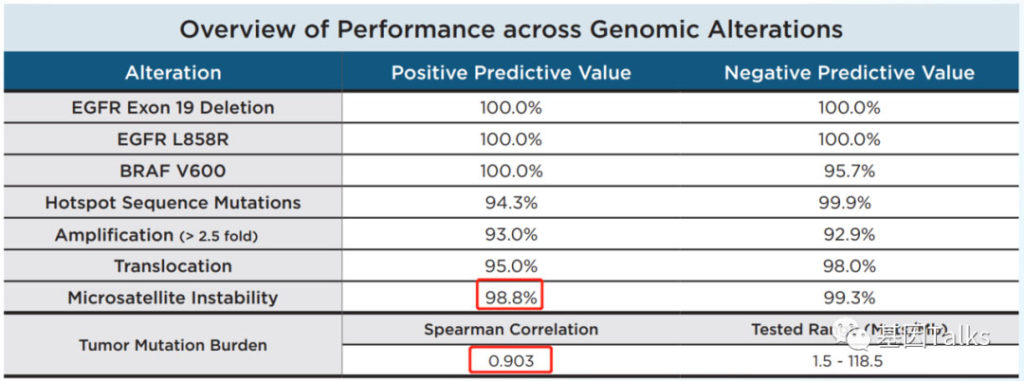
⑧ 基因组变异的性能参数:点突变和插入缺失基本为100%,热点突变检出率为 94.3%,扩增检出率93%,融合或重排检出率为 95%,MSI检测的PPV为 98.8%,TMB与参考标准的spearman相关系数为 0.903,TMB范围为 1.5-118.5
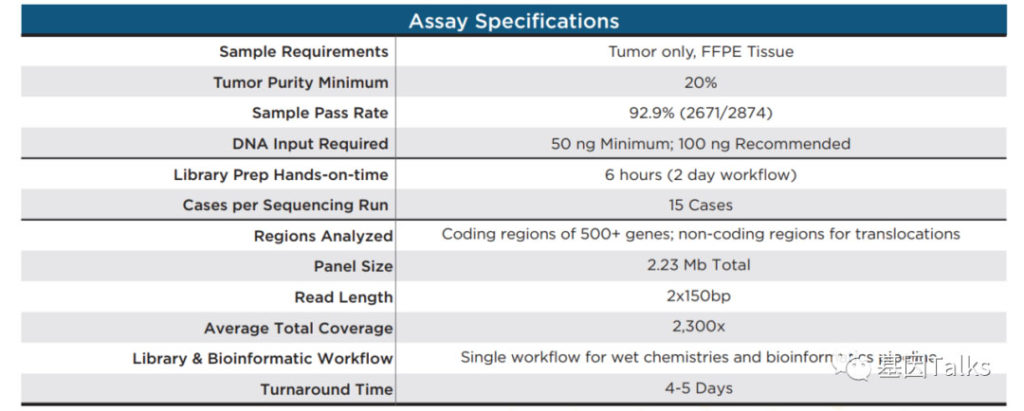
⑨ 质控要求:
样本要求:肿瘤组织,FFPET
肿瘤纯度:最低 20%
样本合格率:92.9% (2671/2874)
DNA上样量:推荐100ng,最低50ng
手动建库时间:6h(2天)
测序混样:15个样本
区域分析:507基因编码区,易位的非编码区域
Panel全长:2.23Mb,CDS区1.33Mb
测序读长:2x150bp
测序深度:2,500X(平均2,300X)
文库和生信流程:一体化湿实验生信流程
报告周期:4-5天
⑩ 检测流程:DNA提取 ➝ 文库构建 ➝ 目标区域杂交捕获 ➝ NGS测序 ➝ 自动化生信分析 ➝ 出具分析性报告。

从2017年到2020年,FDA陆续批准或认证 MSK-IMPACT(468基因),F1CDx(324基因),Omics Core(19,396基因)及 PGDx Elio Tissue Complete(507基因)上市,我们可以基本断定,肿瘤NGS检测的发展方向一定是从小panel到大panel。临床药效的分子标记物将不再局限于单基因、单位点,包含更多基因和位点的NGS大panel将是未来分子检测项目的发展趋势,尤其是肿瘤免疫治疗标志物检测(TMB/MSI等)如此火热的情境之下,多基因的平行检测才是“王道”,小panel到大panel则是精准医学发展的必然趋势。目前,国内已有几家肿瘤基因检测公司的NGS大panel正在申报(注册检验)中,其中就包括TMB标志物的检测,TMB重返巅峰指日可待。那么,谁将成为中国首个多基因NGS大panel上市的公司呢?我们拭目以待。
2019年10月15日,中国食品药品检定研究院(中检院)发布了关于TMB 注册检验用体外诊断试剂国家标准品和参考品说明书公示的通知,旨在告诉我们TMB检测性能评价需要合适的参考品,包括突变位点检测准确性评价,TMB检测一致性评价,和WES一致性评价,和具有临床药效样本检测一致性评价等。
参考资料:
1.http://www.spjnews.com/2020/04/29/personal-genome-diagnostics-receives-fda-clearance-for-pgdx-elio-tissue-complete-the-first-comprehensive-genomic-profiling-diagnostic-kit-for-cancer/
2.https://www.personalgenome.com/products/tissue
