2019年2月,葛兰素史克与德国默克宣布进行合作,共同开发和商业化M7824药物。这是一种TGF-β+PD-L1双靶药物,也是TGF-β靶点研究进程最快的一种药物。
TGF-β在晚期恶性肿瘤的发生发展中扮演着不可忽视的角色。近年来,随着PD-1/PD-L1靶向药物的大热,TGF-β作为重要的抗癌靶点,再次获得了诸多关注。有很多药企都开始向TGF-β抗体药物方向布局。
其中最快的当属德国默克的M7824,已经进入了Ⅱ期临床阶段。葛兰素史克也看准了这一商机投入大量资金与德国默克联合开发这款药物。
而在TGF-β的抗体药物研发中,多数企业都选择了TGF-β与PD-1/PD-L1的联合疗法。这样的多靶点联合治疗很可能会成为未来靶向药物研发的主要方向。
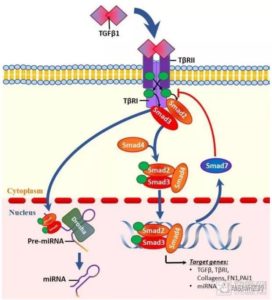
图:TGF-β信号通路的结构
图片来源:Pacific Huynh, Zhonglin Chai.Transforming growth factor β (TGFβ) and related molecules in chronic kidney disease (CKD).CLINICAL SCIENCE 133(2),287-313(2019).
TGF-β信号通路在胚胎和人体的生长发育过程中扮演着重要的角色。科学家们也已经对TGF-β信号通路的构成进行了多年的研究。TGF-β是一种信号蛋白,很多胞外信号都会影响TGF-β基因的表达,如葡萄糖浓度、氧化压力和部分细胞因子等。
在经典的TGF-β信号通路中,TGF-β在细胞中表达后,会被释放到细胞外内环境中,通过与膜上受体TGFβRII(简写为TβRII)结合,激活TβRII,使其与TGFβRI(简写为TβRI)结合形成复合体。
被激活的TβRI/TβRII复合体会磷酸化下游的Smad2和Smad3。被磷酸化的Smad2和Smad3会与另一Smad家族蛋白Smad4结合,形成磷酸化的Smad2/3/4复合体。磷酸化的Smad2/3/4复合体进而入核,调控下游靶基因的表达情况。
TGF-β下游调控着一系列与细胞黏性相关的蛋白。在肿瘤微环境中TGF-β含量的上升将降低细胞黏性,从而促进肿瘤的上皮间质转化(EMT)过程。这一过程是肿瘤转移的开端。
因此TGF-β信号的高表达往往与免疫逃避、治疗抵抗和较差的预后相关联。在多种恶性肿瘤样本中,都可以观察到TGF-β信号通路相关因子的表达上升,并且其表达情况和癌症转移乃至患者预后都有着密切的联系。
然而在另一方面,TGF-β的另一部分下游靶点则起着阻断细胞周期,抑制细胞增殖的作用。因此,TGF-β在肿瘤进展中同时扮演着促进转移和抑制肿瘤生长的角色。这样的角色定位,使得学术界长期以来对于要不要使用TGF-β作为药物靶点治疗癌症一直存有争议。
在迄今为止的TGF-β靶向药的临床应用过程中,抑制TGF-β信号通路对患者的疾病进展和预后都起到了积极作用。因此对于抑制TGF-β产生负面效应的顾虑也就不攻自破。
聚焦中心:TGF-β与PD-1/PD-L1双管齐下
TGF-β靶向药物与PD-1/PD-L1靶向药物联合使用是目前TGF-β药物临床试验最主要的方向。PD-1/PD-L1是时下最火的靶向药物,但是药物使用中产生的药物抵抗问题却难以被消除。这也是目前有关PD-1/PD-L1药物的研究中最受关注的部分。
有很多研究已经证实了,TGF-β信号通路在肿瘤对PD-1/PD-L1药物的抵抗中扮演着重要角色,TGF-β很可能通过诱导Tregs(调节性T细胞)和抑制效应T细胞来影响肿瘤微环境的平衡。
2016年发表在《Cell》上的一篇文章中,研究者们在产生PD-1药物抵抗的患者样本中发现了TGF-β信号通路相关因子的明显上调。
在2018年,《Nature》上曾发表了两篇相关论文,分别在转移性结直肠癌和转移性尿路上皮癌小鼠模型中,证实了同时抑制TGF-β/TβR和PD-L1可以有效的抑制小鼠肿瘤的转移,并提高小鼠生存率。
这一系列科研成果都表明了,抑制TGF-β信号通路可能会提高PD-1/PD-L1靶向药物的治疗效率。
知名药企纷纷布局

图:已经进入临床阶段的TGF-β靶向药物
目前已经有很多药企在向TGF-β相关的靶向药物方面布局。
动脉新医药查询后发现,进入临床阶段的药物共有9种,其中以德国默克的M7824最快,已经进入了Ⅱ期临床阶段。在进入临床阶段的9种药物中,有6种都选择PD-1/PD-L1与TGF-β/TβR双管齐下,足见抗体药物联合治疗在未来生物医药发展中的重要性。
在这些药物的临床试验上,也分别选择了不同的试验方法。
德国默克的M7824在Ⅱ期临床试验中,直接选择了与美国默沙东靶向PD-1的Keytruda进行头对头试验,以充分证实自己的药效;赛诺菲的SAR439459和艾伯维的ABBV-151都选择了与PD-1靶向药的联合疗法,并在临床试验中,专门招募抗PD-1/PD-L1治疗失败的患者进行临床试验;而辉瑞的PF-06952229和Isarna的Trabedersen则选择针对TGF-β高表达的患者进行单一治疗。
进展最快的药物:M7824
M7824(bintrafusp alfa)是德国默克的在研新药,是一种抗PD-L1/TGF-β的融合蛋白,即这种药物同时具有靶向PD-L1和靶向TGF-β的功能,因此又被有些人称为“升级版PD-(L)1抗体药物”。
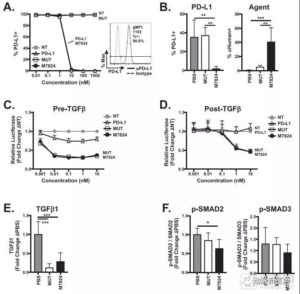
图:M7824的机理研究
图片来源:Karin M. Knudson, Kristin C. Hicks,et al.M7824, a novel bifunctional anti-PD-L1/TGFβ Trap
fusion protein, promotes anti-tumor efficacy as monotherapy and in combination with vaccine.OncoImmunology 7,e1426519(2018).
M7824在临床之前就已经进行了多方面的药理研究,从基础机理角度证实了其对PD-L1和TGF-β的双重抑制作用。如预想的一样,M7824和avelumab(辉瑞和德国默克联合开发的PD-L1抗体药物)有几乎一样的PD-L1结合效率。
并且在小鼠实验中,M7824也表现出了同样优秀的PD-L1特异性结合能力。而在另一方面,M7824与avelumab在TGF-β的调节能力上表现出了明显的差距。
在M7824的作用下,胞外基质中的TGF-β1含量有明显降低。同时,M7824可以有效的降低TGF-β下游Smad2的luciferase信号,并且可以明显的抑制SMAD2和SMAD3的磷酸化水平。
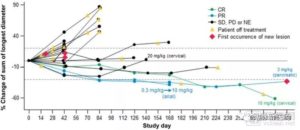
图:M7824的Ⅰ期临床研究情况
图片来源:Julius Strauss, Christopher R. Heery.et al.Phase I Trial of M7824 (MSB0011359C), a Bifunctional Fusion Protein Targeting PD-L1 and TGFβ, in Advanced Solid Tumors.Clinical Cancer Research 24,1287-1295(2018).
2018年6月初,在美国临床肿瘤协会年会(ASCO)上,M7824公布了两项关键临床数据。其中一项临床试验是对晚期非小细胞肺癌患者使用每两周1200mg剂量的M7824。
在此项研究中,M7824的治疗有效率明显高于PD-1的历史数据,在PD-L1高表达患者中有效率甚至达到了71.4%。另一项临床试验中,通过对17位HPV相关癌症患者使用不同剂量的M7824进行治疗,总体有效率高达41.7%。而PD-1抑制剂针对此类患者的有效率一般只有15%到20%。
Ⅰ期临床试验的优秀结果极大的鼓舞了研究人员的信心。2018年9月,M7824开始了进一步的Ⅱ期临床试验,并直接选择与Keytruda进行头对头试验。这项国际多中心试验预计招募试验人员1500人,其中预计在中国北京、上海和广州的四家医院招募30名患者入组试验。
目前这款药物的研发进展也已经受到了FDA的关注。2018年12月,FDA授予M7824治疗胆管癌的孤儿药资格,这意味着M7824在美国境内进行的一系列未来研发工作都将顺风顺水。同时M7824在国内也已经申报了两项临床试验,其中一项已经在2018年12月审批通过。
2019年2月,看到了M7824潜力的葛兰素史克与德国默克宣布进行合作,共同开发和商业化M7824。该项目的估值最高将达到37亿欧元。
根据协议,默克集团将获得3亿欧元(3.4亿美元)的预付款,并有资格获得由M7824肺癌项目高达5亿欧元(5.66亿美元)的拨款。
此外,默克集团还能从葛兰素史克获得高达29亿欧元(33亿美元)的资金支持。两家公司将共同进行新技术的开发和商业化,合作项目的所得利润和成本将平等分摊。
多靶点联合治疗将成未来生物医药行业的主旋律
靶向药在近几年的迅速发展让投资人们趋之若鹜。在2018年销量前十的药物中,有9种都是靶向药,剩下的一种是疫苗。
但是在靶向药的实际使用过程中,单一靶点逐渐无法满足多数患者的治疗需求,比如对治疗不敏感或产生药物抵抗。如果在此时引入另一靶点同时起效,则很有可能会大幅改善患者的治疗情况。
双特异性抗体或多种靶向药物的联合治疗,都是以这种思路来完善目前的治疗体系,并且已经有相应的治疗方案通过FDA审批上市。
可以预见的是,在未来的生物医药领域发展中,除了继续增加靶点数量,多靶点联合治疗将称为靶向药物研究的主要方向之一。
