传统的肿瘤诊治过程中,基于肿瘤组织的病理诊断及相关分子检测一直是临床医生诊断和治疗的金标准。随着技术的进步,液体活检,尤其是以外周血为主的游离DNA(cell-free DNA,cfDNA)检测越来越多地进入了临床医生的视野,正在悄然改变着临床实践。
然而,究竟何为液体活检?液体活检可以使用哪些样本?液体活检需要注意哪些问题?液体活检临床应用的优势和局限性在何处?液体活检能够应用在哪些方面?这些问题在临床医生的脑海里未必有完整和清晰的概念。
一、基础篇
1、液体活检的样本及检测对象
液体活检(liquid biopsy)通常指对外周血cfDNA的分析,也包括从血液或其他体液中分离和分析肿瘤衍生物质。液体活检的检测样本包括血液、尿液、粪便、脑脊液、唾液、胸水和腹水(注:遗憾的是文中并未提及心包积液,肿瘤所导致的心包积液也可以作为液体活检的样本)(图1)。液体活检的检测对象主要是cfDNA,除此之外还可以检测循环肿瘤细胞、外泌体(包含蛋白质和遗传物质的小囊泡)以及RNA。
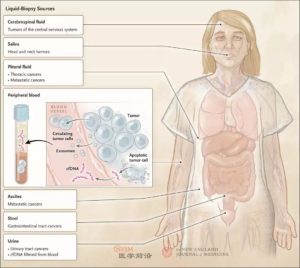
图1. 液体活检的检测样本(来源:N Engl J Med 2018;379:1754-65)
2、cfDNA的定义及其特性
cfDNA是血液中细胞成分之外的小片段DNA,最早于1948年由Mandel 和Metais提出[1]。理论上认为cfDNA是细胞凋亡或坏死后释放入血的,通常其长约150到200个碱基对,半衰期约0.5-1小时。在正常人体中,cfDNA含量极微,通常为10-15 ng/ml,而肿瘤患者的cfDNA含量明显升高。肿瘤患者中,外周血所测得的肿瘤所释放的DNA又称为循环肿瘤DNA(ctDNA,circulating tumor DNA),ctDNA是cfDNA的一部分。肿瘤患者中,ctDNA占cfDNA的比例差异巨大,少至0.1%,多到超过90%。
二、技术篇
1、合格的样本——液体活检的基础
在液体活检的临床应用中,合格的样本是获得准确结果的基础。由于cfDNA的半衰期极短,仅仅0.5-1小时,因此在临床采样后需要尽快分离抽提后进行检验(1-4小时),否则将会大大增加检测的假阴性率。而这样的时间要求在临床实践中极难达到。好在目前临床上进行液体活检时多采用专门的cfDNA采血管,其中含有DNA保护剂和细胞稳定剂,既能够减少cfDNA的降解,还可以避免血细胞破裂所导致的正常DNA稀释ctDNA,可常温下保持cfDNA稳定7-14天,极大地便利了液体活检的临床应用。
《中华医学杂志》于2015年12月8日发表的《非小细胞肺癌血液EGFR检测中国专家共识》中也明确提出“为了采集到最佳血浆标本用于后续提取游离DNA进行EGFR基因突变检测,建议使用如下两种方法之一采集10 ml全血并进一步分离血浆:(1)用含有游离DNA保护剂及防细胞裂解保护剂的专用常温采血管采集全血后轻摇混匀,常温(6-30℃)放置不超过5-7天。(2)用常规EDTA抗凝管(严禁使用肝素抗凝管)采集全血后,两小时内以足够的离心力将全血充分低温离心两次,分离出不含细胞成分的血浆,放置于-70℃冻存直至DNA抽提,或直接进人DNA抽提步骤”。
确保检测样本质量这一点在液体活检的临床应用中尤为重要。临床医生往往会忽视“抽血”这件“小事”,而由于采样的试管选择不当、样本储存不当、处理不及时均会导致液态活检的样本质量不合格,进而所导致的检测结果假阴性在临床上屡见不鲜,临床医生需要熟知并在临床应用中给予足够的重视。
2、敏感的方法——液体活检的关键
由于cfDNA在外周血中的含量极低,必须有足够敏感的检测方法才能够达到检测的目的。目前,满足cfDNA检测的方法包括基于聚合酶链反应(PCR)的BEAMing方法或微滴式数字PCR方法(ddPCR),此类方法可以检出0.01%或更少的等位基因频率的变化。此外,近些年进展更为迅速的二代测序方法(包括全基因组测序、全外显子测序和目标基因测序)也是液体活检的有力武器,通过barcode的方法大大提高了二代测序的准确性和敏感性(图2)。
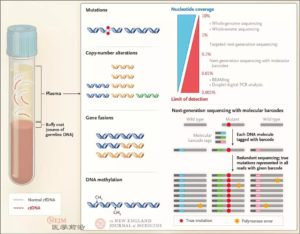
图2. cfDNA的提取及检测方法的敏感性(来源:N Engl J Med 2018;379:1754-65)
3、靠谱的结果——临床医生的信心
说一千道一万,通过液体活检获得靠谱的结果,从而指导临床应用是检测的最终目的。在液体活检临床应用的早期,质疑的声音不绝于耳,其理由非常充分:液体活检与组织活检的一致率太低[2]。尤其是约翰霍普金斯大学医学院的两位研究人员在JAMA Oncology上发表研究指出,不同机构进行的检测得到的结果差异非常大,两家权威机构同时检测的40名患者样本中,除去6例检测结果被认为无效的外,其余34例中测序结果完全一致的只有12例[3]!这在学界掀起了一股对液体活检质疑的声音。其中原因较为复杂,既有患者选择的问题,也有组织异质性的问题。例如组织活检与液体活检的采样时间不一致;治疗后采血故cfDNA含量过低,导致液体活检检测结果阴性;选择患者的肿瘤负荷低,导致外周血cfDNA浓度低于检测阈值等等。在后期,学界意识到了这些问题并加以规避后,更大规模的研究结果证实液体活检与组织活检相比,其一致率在80-90%,尤其是对于治疗有重要意义的驱动基因,其阳性率更高[4-6],液体活检才终于沉冤得雪。
当然,我们不可回避的现实是在临床实践中,的确有15%左右的患者外周血cfDNA含量过低,无法达到检测阈值,这部分患者必须依赖组织活检。此外组织活检所能够提供的病理学诊断以及蛋白表达的检测仍然是液体活检无法提供的重要信息。
这些信息提示我们,在临床选择液体活检时,对患者的筛选非常重要。笔者所在中心在临床上也观察到了肿瘤负荷大、外周血肿瘤标记物显著升高的患者液体活检阳性率更高的现象。另外,液体活检不能替代病理诊断,获取足够的组织明确病理仍然是肿瘤内科治疗的基础。
三、应用篇
液体活检与组织活检相比,具有相当显著的临床应用优势:第一,无创,尤其适用于难以获得肿瘤组织的情况;第二,克服肿瘤异质性所导致的穿刺结果片面性;第三,可以监测临床无明确肿瘤病灶的患者。在临床上,主要应用于以下几种情况。
1、发现患者的基因突变。如前所述,目前液体活检客观描述肿瘤基因学的变化已经得到了诸多研究的证实。与传统的组织活检相比较,液体活检既有较高的一致率,还有其独特的无创、发现肿瘤异质性等优势,其正在改变着临床实践。
2、监测抗肿瘤治疗效果。尽管不同瘤种和个体间cfDNA的差异巨大,但在同一个个体中,cfDNA的变化能够较好地反映治疗的疗效。尤其是cfDNA的半衰期短,可以在治疗起效后1到2周迅速下降,较传统的CEA、CA199等肿瘤标记物更加敏感。
3、发现耐药性和异质性。抗肿瘤治疗过程中,不可避免地出现耐药,此时寻找耐药原因至关重要。而疾病进展时,通过二次活检获得组织标本并非易事。此时,通过液体活检,发现耐药和亚克隆的形成,能够指导后续用药方案的制定。
4、发现术后残留微病灶。对于根治性切除术后的肿瘤患者,是否能够从后续的辅助化疗中获益仍无满意的预测手段。例如对于II期结肠癌术后,研究表明手术后数周内cfDAN检测阳性的患者,无一例外出现肿瘤进展[7],对于此类患者进行辅助化疗,无疑会对患者的预后产生积极的作用(图3)。
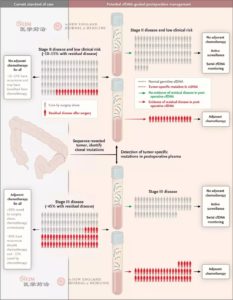
图3. 液体活检指导术后辅助治疗(来源:N Engl J Med 2018;379:1754-65)
5、早期诊断亚临床肿瘤。对于健康的无症状人群,应用液体活检早期诊断肿瘤如获成功,则“滴血验癌”将成为现实,无疑是液体活检最具吸引力之处。目前在这方面的应用探索正在进行,特别值得称赞的是中国学者在无症状人群中抽血检测EB病毒DNA进行鼻咽癌的早期筛查,在EBV阳性的人群中,超过10%的无症状人群发现鼻咽癌[8]。另外一项联合cfDNA和蛋白质检测的Cancer SEEK研究诊断肿瘤的敏感性在69-98%之间,特异性为99%[9]。这些研究都充分展现了液体活检在无症状人群中早期诊断肿瘤的潜在价值。
液体活检癌症早筛应用技术大比拼
卢煜明教授发布液体活检新成果!利用特异性cfDNA末端坐标追踪癌症信号

循环肿瘤DNA(ctDNA)携带着与癌症相关的分子特征,包括体细胞突变、癌症相关病毒序列、拷贝数异常和DNA差异甲基化等。通过检测ctDNA的癌症分子特征有助于了解癌症的发生和发展。因此,ctDNA在基于液体活检的癌症早期研究中有着重要应用前景。
目前,大多癌症早筛研究都集中于检测癌症患者中具有广泛代表意义的生物标志物。但癌症是一类高度异质的疾病,不同癌症会有不同的特异性基因突变。此外,在癌症的早期阶段,血浆中ctDNA的含量微乎其微,基于某一突变的体细胞突变量甚至更低。
为了克服以上问题,增强ctDNA检测癌症的灵敏度,香港中文大学卢煜明教授研究团队日前对基于血浆ctDNA的检测技术进行了改进,开发了一种可检测血浆中癌症相关体细胞突变总量的方法,并研究了ctDNA上是否存在其他类型的分子特征。卢煜明教授研究团队报告了肝癌、肝移植和肝炎患者群组的血浆样本分析结果,并发现可通过追踪cfDNA偏好末端坐标来寻找血液ctDNA的癌症信号。相关研究结果于2018年10月29日发表在PNAS期刊。
近年来,人们发现血浆DNA断裂并不是一个随机的过程。例如,在孕妇的血浆中,某些具有特异末端的cfDNA主要来自胎儿,而其他cfDNA分子则主要含有来自母体的末端结构。基于此,研究团队将注意力转向寻找除癌症基因突变之外的其他癌症信号来源,并假设组织或肿瘤相关的cfDNA偏好末端特征也存在。在卢煜明教授的带领下,研究团队开始通过不同的方法从cfDNA片段中收集与癌症相关的信号。
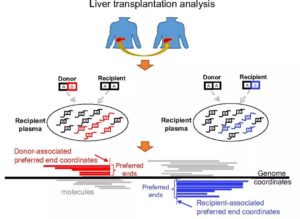
图1. 鉴定cfDNA末端特征的原理示意图
研究团队利用一组肝移植病例的血浆样本,鉴定了出近10,000个与肝脏相关的偏好末端坐标位点,首次证明了在某些基因组坐标下,来自肝脏的cfDNA分子比非肝来源分子更倾向于出现偏好末端。同时,研究团队还分析了一组肝癌患者的基因测序数据,并将其与慢性乙肝患者的样本测序数据进行了比较,发现了数以百万计的血浆DNA癌症偏好末端坐标位点,其中,在HCC和慢性HBV感染患者中鉴定了980万和1380万个偏好末端坐标位点。
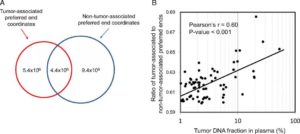
图2. 肿瘤相关和非肿瘤相关的cfDNA偏好末端坐标。(A)根据肝细胞癌患者和慢性乙肝病毒携带者血浆中DNA片段末端的比较,确定cfDNA偏好末端坐标的数目。(B)肿瘤与非肿瘤相关cfDNA偏好末端坐标与肿瘤DNA组分比值的相关性分析
分析还发现,这些具有癌症特异性末端坐标的cfDNA分子丰度也与患者的肿瘤DNA组成密切相关,即使在那些仅进行浅层测序的样本也是如此。这表明,体细胞突变和肿瘤相关偏好末端丰度可作为ctDNA的一个可识别特征。而与基于基因突变的检测方法相比,片段末端检测或许能够提供一种更廉价的癌症信号寻找方法。
卢煜明教授表示,此前为检测循环体细胞突变而开发的许多方法可能也适用于检测肿瘤相关cfDNA末端坐标。因此,将体细胞突变检测和肿瘤相关DNA末端坐标进行结合,具有可以大大提高液体活检灵敏度的潜力,评估这些末端坐标在早期癌症无创检测的价值也是非常值得关注的。
此外,研究团队在论文中还描述了他们开发的用于检测血浆癌症相关体细胞突变总量(包括驱动因素和被动因素)的动态滤波算法。研究团队还使用了其他信息学和校正工具来区分来自胚系突变或其他非肿瘤DNA突变来源的癌症相关信息。由于每个血浆DNA样本被测序到>100X人类单倍体基因组覆盖范围,因此在覆盖相关位点的多个序列reads之间应该存在真实的体细胞突变。该算法根据每个假定体细胞突变碱基位置的测序深度,应用不同的读取阈值。只有在超过该位点阈值的多个reads取中,才会被保留作为一个候选变体。
研究结果表明,该算法可以显著提高ctDNA中体细胞突变特异性的鉴定效率,阳性预测值(PPV)从8.8%提高到85%。该算法在相邻的正常肝组织(96种变体)、脐带血浆(133种变体)和慢性HBV感染患者的血浆(222种变体)中仅鉴定了少数的假阳性变体。
该研究发现,具有特异末端cfDNA的定量评估与血浆中肿瘤衍生的或肝脏衍生的血浆DNA量相关,整个基因组中有数百万个与肿瘤相关的cfDNA末端坐标,通过分析cfDNA末端坐标,可以帮助我们鉴定相关cfDNA的起源组织,识别病理学或癌症的器官。通过液体活检技术检测肿瘤相关的cfDNA末端来捕获癌症信号,或许可以成为一种经济有效的新型癌症检测手段。
灵敏度80%!因合生物发表癌症早诊最新数据

2018年10月27日,因合生物关于“通过超高深度靶向测序检测ctDNA突变进行肺小结节良恶性辅助诊断”的阶段性研究成果发表在BioRxiv上,研究结果显示,采用人工智能多维辅助诊断模型,可将肺癌检出灵敏度提高至80%,优于GRAIL近期公布的CCGA研究最新数据。
据悉,该阶段性研究成果共纳入了192例即将手术的肺占位病变患者(良性及早期肺癌患者为主),严格参照ICH国际临床研究标准开展,目的在于验证以ctDNA突变超高深度靶向测序为重点的人工智能多维信息辅助诊断模型,在肺小结节良恶性鉴别中的作用。
该研究在术前和术后采集患者的血样以及组织样本,并对每位参试者的血浆ctDNA、白细胞基因组DNA(gDNA)和肿瘤组织gDNA进行超高深度靶向测序,进行结果比对与数据统计,在65个肺癌驱动基因以及相关基因的编码区域中,平均测序深度高达35000X,使得灵敏度达到可检测0.2%的罕见突变的水平。在ctDNA单一维度结果的基础上,研究人员通过将ctDNA、年龄、吸烟史、蛋白标志物等多种与肺癌相关的因素纳入到多维人工智能模型中,采用10-fold-cross-validation对结果进行交叉验证。结果显示,在保证特异性为99%时,可以将检测的总体灵敏度提高到80%,显著高于单独使用一个指标进行判断,在各个肺癌分期中其检出率也高于使用单一的指标,如下图所示。
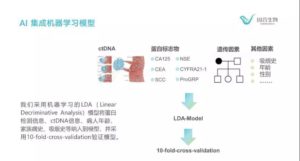
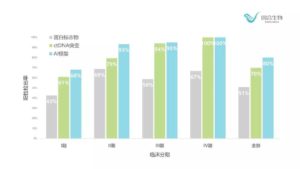
在本次发表的阶段性研究成果中,入组患者包括1 / 4的良性肺部疾病和3 / 4的肺癌患者。64%的癌症患者处于肺癌I期,是目前已知的国内外研究中,早期患者占比较高的研究之一。研究结果显示,在组织gDNA和血浆ctDNA样本的基因突变综合检测产生的结果为灵敏度91%,特异性88%;采用ctDNA检测时,灵敏度为69%,特异性为96%。肺癌患者I期、II期、III期和IV期的检出率分别为63%、83%、94%和100%。
前不久,国际领先的美国癌症早筛公司GRAIL在欧洲肿瘤内科学会(ESMO)年会上发布了CCGA研究泛癌早筛项目的最新数据。其中,在肺癌血浆 ctDNA检测方面,在不同病理组织学亚型中一致地检测到肿瘤信号,包括100%(5/5)的小细胞肺癌病例、65%(11/17)的鳞状细胞癌病例以及60%(12/20)的肺腺癌病例。将因合生物的“肺影追凶”阶段性成果与前期GRAIL发布的结果相比较,我们可以看到如下结果:
![]()
该比较结果说明,血浆ctDNA检测结合AI算法,将大幅度提高肺小结节良恶性鉴别的能力,并成为最有前景的高危人群早筛新技术,为肺癌早期诊断提出了新思路。
可提前4年发现癌症甲基化信号!鹍远基因公布多癌种早筛队列研究初步成果,或可用于5种常见癌症早期筛查
此前,DNA甲基化已被证明具有组织特异性,可用于早期癌症检测,并可根据循环肿瘤DNA(ctDNA)甲基化特征追踪到肿瘤原发部位。2017年,鹍远基因联合创始人、美国加州大学圣地亚哥分校生物工程系张鹍教授利用开发的高通量甲基化无创检测新技术MONOD,首次实验证明可以利用血液中的ctDNA甲基化信号进行癌症筛查和溯源(Nature Genetics,2017)。
提前4年发现癌症甲基化信号
近日,鹍远基因生信分析副总监Athurva Gore博士在2018 ASHG会议上,报告了应用鹍远原创研发的新一代ctDNA甲基化单倍型检测技术PanSeer在癌症早期检测研究中的初步数据分析结果。研究结果显示,PanSeer检测能够比临床诊断最多提前4年发现5种常见癌症的微量癌症甲基化信号,总体敏感度为89.4%。
2016至2018年,鹍远基因与复旦大学泰州健康科学研究院合作进行了基于泰州健康队列癌症早期筛查的研究(TLS队列研究)。根据此前报道,泰州队列自2008年起,采集了120,000多名年龄在30-80岁之间成年人血液样本,并进行了为期10年的随访,是目前国内外唯一可以提供多种癌症确诊前样本的队列,用以验证癌症早筛。研究团队利用PanSeer检测技术,在泰州队列癌症个体样本和健康者样本中,最终证明ctDNA甲基化单倍型检测可以比临床诊断提前数年发现癌症信号,筛查癌症。研究覆盖了中国人群癌症发病率和死亡率最高的五个癌种(肺癌、肝癌、肠癌、食管癌、和胃癌)。
鹍远基因方面表示,该检测技术的假阳性率为7%。目前,该公司正在持续研究并改进PanSeer检测技术。
结直肠癌检测产品引关注
2018年10月18日在上海,鹍远健康宣布其与复旦大学附属肿瘤医院、南方医科大学南方医院联合研究验证的基于高通量测序技术的无创ctDNA甲基化检测项目——“ColonES®常乐思®”正式上市。该公司表示,常乐思®检测只需10mL外周血,即可一次检测1000多个结直肠癌及癌前病变特异甲基化区域,可用于人群结直肠癌、结直肠进展期腺瘤(癌前病变)的检测,进展期腺瘤检出率大于90%,早期腺癌检出率大于95%。
与此同时,该公司也在美国圣地亚哥的ASHG上同步公布了相关研究成果。在美国的会议中,鹍远基因美国业务推广经理Dale Yuzuki对该产品数据进行了补充介绍。他表示,在包括癌前腺瘤、I期和II期至IV期癌症患者的1200多个个体的单盲回顾性研究中,ColonES®常乐思®检测腺瘤的敏感性为91%,对I-IV期结直肠癌敏感性为94%-97%,特异性为99%。Yuzuki表示,目前公司正努力使该检测方法通过FDA批准,预计很快就会与FDA就未来的临床试验进行沟通。
对于这类检测项目的发展前景,Yuzuki认为,在美国常乐思®检测可能与基于粪便的Cologuard基因筛查拥有相似的市场,Cologuard已经得到了FDA的批准,并用作非侵入性筛查,其阳性结果可反映结肠镜检查结果。从商业角度看,结直肠癌早期筛查是一个非常有吸引力的市场,因为相关检查已经纳入医保。
新型技术推动癌症早筛
除鹍远基因外,国外多家其他公司也在关注结直肠癌早期检测市场。例如,2018年早些时候,Cellmax Life在美国开始进行临床试验,利用循环肿瘤细胞(CTC)进行结直肠癌筛查,并计划提交FDA审批。与此同时,Freenome也希望进入结直肠癌早期检测市场,并在10月初提交了关于其cfDNA的分析数据,结果显示,在早期结直肠癌患者的队列中,其检测方法总体敏感度为82%,特异性为85%。此外,Grail正在进行一项15000人的试验,以建立一套cfDNA参考集,在此基础上可以进行结直肠癌早期检测试验。
对于逐渐拥挤的液态活检和癌症早筛市场,鹍远基因方面表示,其他公司虽然也在提供所谓的液体活检分析,但大多是利用ctDNA测序为那些无法进行活检的癌症患者进行肿瘤基因组分析,或监测病情进展或治疗反应。与之相反,鹍远基因专注于癌症早期检测。
值得关注的是,相比于其他检测手段,高通量无创甲基化检测方法PanSeer能够克服传统用于甲基化检测的亚硫酸氢盐建库方法的局限大幅提高转化效率,同时应用单倍型分析方法提高分析灵敏度,从而可以比其他方法用更少的DNA检测癌症的甲基化特征。目前,该公司正计划进行一项大型前瞻性队列研究,以进一步在多个癌种中验证PanSeer检测,以及能否改善癌症患者的预后。
通过AI辅助识别ctDNA,「思勤医疗」想要实现癌症早筛的大规模普及

根据国家癌症中心2017年发布的最新调研数据,中国每年新发400多万癌症病例中,60%的患者在确诊时已经进入中晚期,意味着他们已经错失了癌症治疗的最佳时期,患者5年生存率相对较低——只有38.9%,而美国是68.0% 。其中一个重要的原因是,我国的癌症早筛还不普及,癌症诊断目前主要依靠组织活检、影像学检测等:前者往往为侵入式操作,对病人体质要求较高;后者又对早期肿瘤的识别力较低。
研究表明,在影像检验显示出明显的肿瘤发病迹象前,早期患者血液中可能已经出现循环肿瘤细胞(简称CTC)检测、循环肿瘤DNA(简称ctDNA),也就是说通过CTC检测和ctDNA检测(基于高通量测序技术)可能实现癌症早筛。与经典肿瘤诊断技术相比,该技术除了能更早地检测到肿瘤的存在,还只需抽取患者少量血液,能减少痛苦并支持多次取样,从而帮助人们更有效地进行癌症早筛以减少晚期癌症的发生,最终为国家和家庭节省巨额的治疗费用。
可以说,肿瘤液体活检技术带来的是一个价值万亿的蓝海市场。不过,该技术目前还面临着信息含量低、测序噪音高、器官溯源难这三大瓶颈。36氪近期接触的思勤医疗2018年年初成立,定位于癌症早期筛查生物科技公司,目前已在深圳自建了实验室,并自主研发了一款泛癌种早筛产品思康宁——能通过分析ctDNA片段癌症基因突变和其他多组学指标,并采用多变量算法结合大数据和人工智能判断有无癌症并对癌症进行定位。
根据创始人茅矛博士介绍,一方面,思康宁能检测是否有癌症,另一方面也能对癌症受累器官进行溯源。其核心技术主要在3个方面:提高分辨率;降低噪音——通过一套算法识别血液中的干扰因素(可理解为出现在正常人身上的生物标记物);再通过机器学习总结标记物与受累器官的关系规律,从而进行溯源。据悉,其算法的训练数据主要来自于公开数据集,上述技术已申请了2项美国专利。
在商业化方面,茅矛表示,前期主要是为体检中心和保险公司提供点对点的癌症早筛血液检测的解决方案;待思康宁通过审批后,则会向B端销售相关体外诊断试剂盒(抽取10ml血液即可);后续也会考虑延伸到C端。渠道方面,茅矛介绍到,公司将对标无创产前筛查(NIPT)类企业,主推医院的检验科室、体检中心。思勤的计划是将思康宁的售价控制在1000元人民币以下,帮助实现癌症早筛的大规模普及。他表示,降低成本的核心在于——在测序上不用进行扩增以及使用更优化的算法。
据悉,目前思勤医疗已与中山大学孙逸仙医院和北京大学深圳附属医院展开了癌症早筛、术后残留评估、预后预测等多项科研合作,进一步优化算法。第一批测试结果显示,其特异性有99%,灵敏度有60%,与行业顶尖公司Grial公开数据持平。另外,公司也和多家体检机构达成合作,来开展大规模前瞻性研究。公司计划在明年1月申报CFDA认证,待获批后再正式大规模推向医疗渠道。
GRAIL发布最新数据!以液体活检进行癌症早筛具有高度特异性

近日,癌症早筛公司GRAIL于欧洲肿瘤内科学会(ESMO)年会上发布了CCGA研究项目的最新数据。当前研究结果显示,利用血液进行癌症早期筛查不仅可行,而且在不同类型癌症中还具有高度特异性。
GRAIL希望在尚未出现症状的癌症患者血液中寻找肿瘤DNA的蛛丝马迹,进而对癌症进行早期筛查和诊断。为了实现该目标,GRAIL所启动的临床试验,即“循环游离基因组图谱研究”(Circulating Cell-free Genome Atlas,CCGA)是迄今为止规模最大的临床项目之一。这项雄心勃勃的前瞻性纵向队列研究已纳入约15,000例受试者(70%癌症患者,30%非癌症患者),并将追踪随访5年。GRAIL使用靶向panel和超深度测序策略对受试者血液样本进行分析,探索血液游离DNA表达模式和水平变化,帮助其开发癌症早筛产品。

图1. CCGA研究整体设计
今年早些时间,GRAIL在2018年美国癌症研究协会(AACR)年会和美国临床肿瘤学会(ASCO)年会上发布了CCGA首个子研究约1,800例参与者的血液样本研究数据。在首个子研究中,三种原型基因组测序分析方法被用于分析共计约2800例参与者的血液样本。
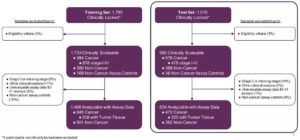
图2. CCGA首个子研究整体设计
根据此前发布信息,CCGA首个子研究使用的三种原型测序分析方法包括:
- 对cfDNA和白血细胞进行靶向配对测序以检测体细胞突变,如单核苷酸变体、小片段插入和/或缺失;
- 对cfDNA和白细胞进行全基因组测序以检测体细胞拷贝数的变化;
- 对cfDNA进行全基因组亚硫酸氢盐测序,检测cfDNA甲基化异常。
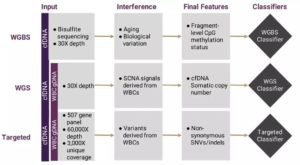
图3. 三种原型测序分析方法被用于全面描述癌症特异性cfDNA信号
本次ESMO年会上发布的最新数据来自该子研究的剩余1,010例受试者,这些受试者的数据被单独分析以验证此前发布的初始结果。研究表明,两个数据集(训练集和测试集)之间的结果相似,原型测序分析方法能够在受试者的血液样本中一致地检测到强烈信号,且对多种癌症类型具有高度特异性。

图4. 训练集与测试集的肿瘤类型分布
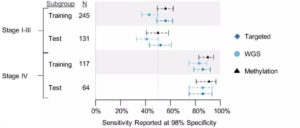
图5. 训练集与测试集间具有一致的检测结果
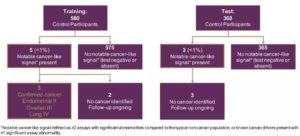
图6. 研究表明高特异性(>99%)是可行的
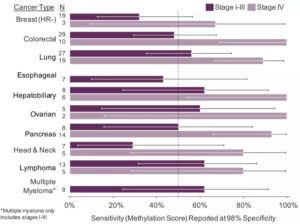
图7. 测试集中检测到的不同类型早期及晚期癌症
在检测HR阴性乳腺癌方面,研究人员能够在早期(I~II期)以及晚期(III-IV期)HR阴性乳腺癌中检测到肿瘤信号,包括三阴性乳腺癌。其中,测试集中68%(15/22)的HR阴性乳腺癌为I期或II期三阴性乳腺癌。
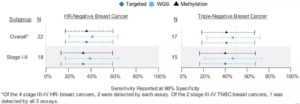
图8. 测试集中不同分期HR阴性乳腺癌的检测情况
在肺癌检测方面,研究人员还成功在不同吸烟状况和组织学亚型人群中对肺癌进行了检测。在测试集中,93%(43/46)的肺癌患者为既往吸烟者;研究人员成功在不吸烟者和吸烟者中检测到肿瘤信号。此外,研究人员在不同组织学亚型中也一致地检测到肿瘤信号,包括100%(5/5)的SCLC病例、65%(11/17)的SCC病例以及60%(12/20)的肺腺癌病例。

图9:测试集中既往吸烟人群肺癌检测情况
在结直肠癌检测方面,研究人员表示可以在结直肠癌的早期阶段(I~III期)以及晚期阶段(IV期),在不同解剖位置一致地检测到肿瘤信号。
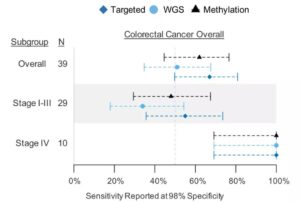
图10:不同分期结直肠癌检测情况
此外,研究人员还发现,大多数cfDNA变异来源于WBC克隆性造血。其中,非肿瘤WBC的cfDNA体细胞突变(SNVs/indels)平均占非癌症组中所有突变的98%以及癌症组的71%。在癌症组和非癌症组中,WBC突变数与年龄呈正相关。大多数克隆性造血突变为低VAF频率(<1.0%)且具有个体特异性。因此,使用靶向方法对克隆性造血进行评估是检测达到高特异性的关键。
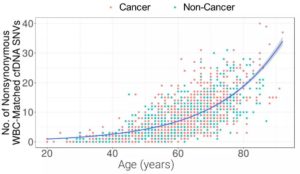
图11. 白细胞cfDNA SNVs与年龄呈正相关
美国UCLA顶尖液体活检实验室获500万美元资助!用毫升唾液开发肺癌早期检测技术

近日,美国加州大学洛杉矶分校(UCLA)宣布,该校David Wong教授研究团队(以下简称‘UCLA团队’)已获得美国国立卫生部(NIH)一项为期5年、总计500万美元的资助。该项目由美国国立卫生部下属的美国国家癌症研究所(National Cancer Institute)所资助,旨在开发用于癌症早期检测的下一代液体活检技术。作为仅有的6个获得资助项目之一,UCLA团队将开发并优化一种基于毫升唾液进行肺癌早期检测的液体活检技术。
据悉,该项液体活检技术研究将招募至少300名肺癌风险患者,使用“EFIRM电场诱导的释放与检测”液体活检技术,检测肺癌风险者的血液和唾液样本。EFIRM技术由David Wong博士领导的UCLA研究团队开发,可从体液样品中检测来自肿瘤组织的基因突变。在前期准备性研究(preliminary research)中,该研究团队已证明EFIRM技术能够检测出早期肺癌,并且与传统的组织活检结果的符合率超过90%。

Dr. David Wong
美国先进科学院院士,UCLA终身荣誉教授,UCLA口腔学院副院长,肿瘤唾液诊断领域的领军科学家
David Wong教授是肿瘤唾液活检技术研究的代表性人物。David Wong教授自16年前在美国NIH资助下开始进行唾液活检研究,分析唾液含有的各类疾病标志物,研究唾液在医学诊断中的临床价值。近几年,该研究团队在唾液癌症检测方面有了新的突破,首次在人体唾液中发现400种环状RNA,并首次以非侵入性的唾液活检技术检测到引发肺癌的基因突变,为癌症液体活检研究开辟了新领域,并引起广泛关注。目前,唾液活检用于胃癌,乳腺癌,胰腺癌,卵巢癌等多项癌症检测都得到了验证。
肺癌的5年生存率仅为18%,因此,早期检测对于肺癌风险人群和患者都至关重要。目前,肺癌的标准早期诊断方法包括肺部低剂量螺旋CT(LD-CT)扫描,以评估是否存在“不明确肺部结节”;随访跟踪这些结节,以评估它们是否发展为肺癌。评估不明确肺部结节的挑战在于如何区分肺癌低风险人群和真正的肺癌患者,前者可受益于未来的随访和LD-CT检查,后者则需要及时手术以拯救生命。因此,开发一种能够与LD-CT 联合使用,并能区分不明确肺部结节的良/恶性,同时又无创、价格低廉的检测方法一直是人们所追求的,但遗憾的是,目前这一目标尚未实现。

Dr.Denise Aberle
“来自国家癌症研究所的项目资助,可以帮助肿瘤学家和临床团队向前迈进一步,以拯救更多的生命。”UCLA David Geffen医学院首席研究员兼放射学教授Denise Aberle博士表示: “我们与UCLA口腔学院合作,旨在建立一个涵盖10种常见肺癌生物标志物的检测方法,最终目标是以新检测方法作为指导,在那些可能患有癌症的未确定病例中识别至少60%的肺癌相关生物标志物。”在Aberle的指导下,该项目将从在UCLA Ronald Reagan医疗中心和其他UCLA健康诊所就诊的肺癌风险患者中获取血液和唾液样本,并在Wong教授的实验室进行检测,在一天之内,患者就会被确定是否需要进行组织活检。所有检测结果将与详细的定量影像学分析相结合,以开发针对不明确肺部结节患者的肺癌预测工具。
该项目合作者,UCLA Geffen学院肺部疾病和重症医学科主任Steve Dubinett博士认为: “能够在这个重要的临床领域取得重大进展,源于我们这个多学科联合团队的专业洞见以及来自校方的全力支持。在接下来的5年中,我们非常期待对这项液体活检技术进行临床验证,它将为不明确肺部结节患者提供有效且廉价的实时检测手段。”
通过对唾液细胞基因表达的分析,可以识别肿瘤细胞的生物特征,进而实现肿瘤的早期发现。此外,唾液活检还具有取材方便、 无痛无创、可避免血源性感染的优势。但是将唾液检测应用到临床还要克服众多限制,其中最为关键的限制因素为基因检测大数据的分析和挖掘。据David Wong教授团队成员介绍,目前,美国UCLA已建立起约30TB的唾液转录组数据库并定期更新,形成了一个可在全世界范围内进行交流的平台。然而,该数据库的深入挖掘与分析尚未有效利用。由于肿瘤发展过程中所带来的唾液基因表达变化具有高度的复杂性(3000多个基因表达会同时发生变化),传统的生物统计学方法无法充分分析其中所蕴含的生物特征,因此,目前无法实现癌症早筛的高准确性。

恺尔生物CEO冯雪阳博士
为解决以上难题,David Wong教授研究团队已经与国内一家致力于开发人工智能癌症筛查系统开发的的基因检测公司恺尔生物正式合作,进行一项基于“唾液+RNA检测+人工智能”胃癌早期筛查系统的临床研究,利用恺尔生物自主研发的恺尔深图TM人工智能系统对唾液基因表达谱进行分析。据恺尔生物CEO冯雪阳博士介绍,恺尔深图TM人工智能系统通过结合无监督学习与监督学习,可根据基因表达谱的变化,准确识别健康机体与肿瘤患者的生物特征差异,从而实现癌症的早期检测。
