免疫检查点抑制剂进入中国,大批非小细胞肺癌(NSCLC)患者将有机会接受免疫治疗,从而获得长期生存的机会。目前唯一在中国市场上市的针对NSCLC的免疫检查点抑制剂——纳武利尤单抗,获批的适应证是:单药适用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性NSCLC成人患者。
中国SDFA的批准适应症中,并没有规定要做任何的检测,比如PD-L1或TMB(肿瘤突变负荷)等。有医生问:“二线使用纳武利尤单抗,是否需要进行PD-L1检测呢?”
首先,问题的起源在于:免疫治疗是否能够找到满意的预测标志物?在免疫治疗的临床试验,研究者试图从多种标志物中探寻免疫治疗可能的获益人群。PD-L1作为一个潜在的预测标志物,但其表达的波动性较大,作为统一的预测标志物存在挑战。Blueprint研究告诉我们,不同平台间检测PD-L1表达水平的一致性不佳,检测方法也尚存较大争议[1]。
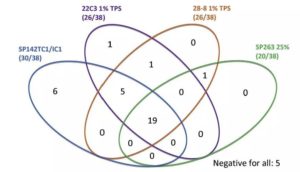
(摘自:Hirsch, F.R., et al., J Thorac Oncol, 2017. 12(2): p. 208-222)
目前认为,PD-L1可以作为伴随诊断,但不一定是最佳的免疫治疗标志物。除外肿瘤细胞和免疫细胞的PD-L1 IHC(免疫组化)检测,针对PD-L1的探索性研究,还包括外泌体PD-L1检测[2]、CTC(circulating tumor cell, 循环肿瘤细胞)上的PD-L1检测[3]、ctRNA(circulating tumor RNA,循环肿瘤RNA)的PD-L1检测[4]等。第二,我们来看看纳武利尤单抗二线治疗晚期NSCLC肺癌的临床试验数据。这方面有3个大型RCT,分别是CheckMate 017/057/078。CheckMate 017研究[5]和057研究[6]都是纳武利尤单抗的全球注册III期临床研究,研究设计相似,不同之处在于前者只入组了鳞癌患者,后者只入组了非鳞癌患者,之所有这样的区别,是因为在研究设计之初考虑到组织学差异对治疗效果可能存在的不同。CheckMate 078研究是中国肺癌领域第一项PD-1抑制剂的III期临床研究。CheckMate 078研究对入组患者没有组织学类型的限制,受试者中的90%来自中国,主要终点是总生存。这项研究也大获成功,首次证实了纳武利尤单抗在中国人群中的疗效与安全性。2018年NCCN NSCLC指南更将对纳武利尤单药作为二线治疗的推荐级别提升至1类。随着随访时间的延长,Checkmate 017和 057研究公布了令人振奋的长期生存数据。这张森林图展示了2年的汇总随访结果[7],根据PD-L1表达的情况的亚组分析。哪怕是PD-L1阴性(1%)的亚组,OS的HR 95%可信区间(CI)也没有碰到1(95% CI上限为0.99)。这张森林图证明,无论PD-L1表达状态如何,二线单药使用纳武利尤单抗都有OS的获益。
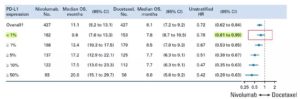
(摘自:Horn, L., et al., J Clin Oncol, 2017. 35(35): p. 3924-3933)
第三,如何看待亚组分析结果,还需要从统计学角度考虑。在CheckMate 078研究中,也对PD-L1的表达对OS的影响做了亚组分析(预设亚组)[8]。在PD-L1表达水平<1%和≥1%的患者中,OS HR分别为0.75(95% CI:0.52-1.09)和0.62(95% CI:0.45-0.87)。PD-L1阴性(<1%)亚组的OS获益,略少于PD-L1阳性(≥1%)亚组(效应值HR:0.75 vs 0.62)。PD-L1阴性亚组OS HR的95% CI上限超越了1,是不是说PD-L1阴性亚组就没有OS获益了吗?
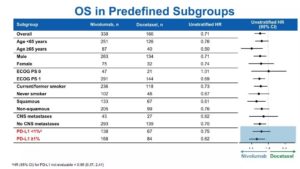
(摘自:Wu, Y.L., AACR, 2018: Abstract CT114.)
亚组分析是指除将所有受试者作为一个整体人群进行统计学分析外,有时会尝试对其中部分人群,即亚组进行分析,如在年龄、性别、手术方式等方面。CONSORT声明[9]对RCT拟定了一份含25项内容的清单,旨在规范报道要求,获得完整、清晰的临床试验方法学和研究结果的信息。

(摘自:Schulz, K.F., et al., BMJ, 2010. 340: c332)
Ⅲ期临床试验的亚组分析有助于筛选出对治疗获益或不获益,对肿瘤患者的个体化治疗有重要意义。亚组分析的结果只能作为一个未来研究的启示,不能作为临床决策的依据;不适当的亚组分析也可能导致夸大或者误导的结果[10]。

☑ 亚组分析要预先确定,少而精。如果一个RCT研究先按照亚组的分组因素进行了分层随机化,那么后续的亚组分析结果要可靠一些;☑ 亚组分析结果证据级别应该理解为一种类似于观察性研究的结果,因为大多数的亚组分析破坏了原始研究的随机化。☑ 对于那些总体人群结果为阴性的RCT,在不满足第1条时却进行多次未加选择的亚组分析,这样的结果需持怀疑态度。
因此,在CheckMate 078中,预设PD-L1亚组的目的是验证PD-L1表达状态对纳武利尤单抗治疗的疗效方向和一致性。虽然CheckMate 078的PD-L1阴性亚组95% CI上限超越了1,但是由于效应值HR的获益还是显著的,所以较比对照组多西他赛单药,纳武利尤单抗还是对PD-L1阴性患者的OS有改善。根据目前的研究证据,二线使用纳武利尤单抗,不需要进行PD-L1检测。无论是PD-L1表达阳性还是阴性的人群,都有不同程度的生存获益。
参考文献:
1. Hirsch, F.R., et al., PD-L1 Immunohistochemistry Assays for Lung Cancer: Results from Phase 1 of the Blueprint PD-L1 IHC Assay Comparison Project. J Thorac Oncol, 2017. 12(2): p. 208-222.
2. Chen, G., et al., Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response. Nature, 2018. 560(7718): p. 382-386.
3. Guibert, N., et al., PD-L1 expression in circulating tumor cells of advanced non-small cell lung cancer patients treated with nivolumab. Lung Cancer, 2018. 120: p. 108-112.
4. Ishiba, T., et al., Frequencies and expression levels of programmed death ligand 1 (PD-L1) in circulating tumor RNA (ctRNA) in various cancer types. Biochem Biophys Res Commun, 2018. 500(3): p. 621-625.
5. Brahmer, J., et al., Nivolumab versus Docetaxel in Advanced Squamous-Cell Non-Small-Cell Lung Cancer. N Engl J Med, 2015. 373(2): p. 123-35.
6. Borghaei, H., et al., Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med, 2015. 373(17): p. 1627-39.
7. Horn, L., et al., Nivolumab Versus Docetaxel in Previously Treated Patients With Advanced Non-Small-Cell Lung Cancer: Two-Year Outcomes From Two Randomized, Open-Label, Phase III Trials (CheckMate 017 and CheckMate 057). J Clin Oncol, 2017. 35(35): p. 3924-3933.
8. Wu, Y.L., Nivolumab Versus Docetaxel in a Predominantly Chinese Patient Population With Previously Treated Advanced Non-Small Cell Lung Cancer: Results of the Phase 3 CheckMate 078 Study. AACR, 2018: p. Abstract CT114.
9. Schulz, K.F., et al., CONSORT 2010 statement: updated guidelines for reporting parallel group randomised trials. BMJ, 2010. 340: p. c332.
10. Wang, R., et al., Statistics in medicine–reporting of subgroup analyses in clinical trials. N Engl J Med, 2007. 357(21): p. 2189-94.





