作者 l Timbersaw 编辑 l 细胞房间
前言
以PD-1/PD-L1、CTLA-4单抗为代表的第一代免疫检查点抑制剂已逐渐成为肿瘤免疫(Immuno-oncology,IO)治疗的基石。而寻找安全有效的,并能与PD-1/PD-L1产生协同效应的新一代肿瘤免疫靶点,是现阶段学术界和工业界关注的焦点,也由此涌现出如LAG3,TIGIT,TIM3,CD47,OX40,4-1BB等一系列免疫抑制性或激动性靶点。
对于实体瘤治疗而言,要克服耐药提高疗效,很重要的一个方面就是解除肿瘤微环境(Tumor micro-environment,TME)对免疫效应细胞的抑制作用。TME是非常复杂的系统,由多种细胞、胞间质、酶、细胞因子、代谢产物等构成,有显著的低氧、低pH以及高压的特点,与正常组织差异巨大。其间很重要的一个免疫抑制机制由CD73-腺苷(Adenosine)代谢信号通路介导。腺苷可以通过腺苷受体(A2AR)抑制T细胞的免疫杀伤作用,使肿瘤实现免疫逃逸,而CD73则是催化腺苷产生的关键酶。
本文将重点介绍CD73-腺苷信号通路对抗肿瘤免疫反应的调节作用,CD73抗体药物的临床前和临床研究进展,以及未来的开发方向。
CD73简介
CD73是NT5E基因编码的胞外-5′-核苷酸酶,蛋白分子量70KD,由葡糖基磷脂酰肌醇(GPI)锚定在细胞表面形成同源二聚体,但同时也可被切割并游离于循环系统。CD73上游的CD39可以催化ATP产生腺苷单磷酸(AMP),所产生的AMP被CD73转化为腺苷,而腺苷会结合下游的腺苷受体(A2AR)(图1)。有研究显示,A2AR通过激活蛋白激酶A(PKA)和Csk激酶,抑制LCK、MAPK、PKC等一系列与免疫激活相关的信号通路,从而发挥免疫抑制作用。
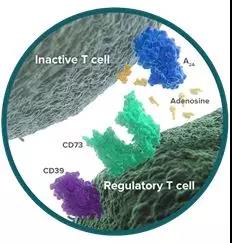
图1. CD39-CD73-腺苷示意图
CD73在肿瘤微环境的癌细胞、DC细胞、Treg(调节型T细胞)、NK细胞、MDSC(髓系起源的抑制细胞)、TAM(肿瘤相关巨噬细胞)等多种细胞表面均有表达。CD73的表达受到低氧诱导因子-1(HIF-1)、TGF-β、EGFR、AKT、β-catenin等分子的调控,尤以行使转录因子功能的HIF-1最为关键。如上文介绍,低氧(Hypoxia)是肿瘤微环境的一个重要特征,低氧诱导HIF-1上调,进而导致CD73在肿瘤微环境广泛表达。放化疗杀伤肿瘤细胞所造成的低氧或ATP富集会促进CD39-CD73-腺苷信号的级联反应,有利于各种促癌类细胞的增殖和功能,而不利于抑癌类细胞。CD73与肿瘤微环境的相关性可参考图2。
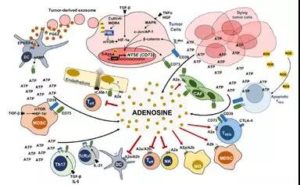
图1. CD39-CD73-腺苷示意图
CD73在肿瘤微环境的癌细胞、DC细胞、Treg(调节型T细胞)、NK细胞、MDSC(髓系起源的抑制细胞)、TAM(肿瘤相关巨噬细胞)等多种细胞表面均有表达。CD73的表达受到低氧诱导因子-1(HIF-1)、TGF-β、EGFR、AKT、β-catenin等分子的调控,尤以行使转录因子功能的HIF-1最为关键。如上文介绍,低氧(Hypoxia)是肿瘤微环境的一个重要特征,低氧诱导HIF-1上调,进而导致CD73在肿瘤微环境广泛表达。放化疗杀伤肿瘤细胞所造成的低氧或ATP富集会促进CD39-CD73-腺苷信号的级联反应,有利于各种促癌类细胞的增殖和功能,而不利于抑癌类细胞。CD73与肿瘤微环境的相关性可参考图2。

另外,PD-1/PD-L1单抗、放化疗等治疗方案可能引起肿瘤微环境CD73表达升高,继而通过腺苷信号抑制免疫反应,使治疗大打折扣,也就是我们常说的获得性耐药(Acquired resistance)。因此,靶向CD73的治疗策略有潜力作为单药或联合疗法应用于临床。
靶向CD73的临床前研究
临床前动物模型研究显示,免疫细胞和非免疫细胞表达的CD73均可以促进肿瘤的免疫逃逸,发展和转移,其中Treg细胞相关的CD73-腺苷信号对CTL(细胞毒性T细胞)和NK细胞功能的抑制最为明显[3]。在动物模型中使用靶向CD73的抗体或基因敲除CD73可以有效阻断肿瘤生长和转移,有趣的是,这些研究也发现了CD73独立于其腺苷酸催化活性的其他功能,如介导细胞黏连和迁移[3, 4]。上述结果可能预示,有细胞内吞(Internalization)活性的CD73抗体有潜力同时阻断其催化活性和非催化功能,“一箭双雕”。
除了细胞内吞活性外,是否保留Fc段也可能影响抗体药物的功效。临床前研究显示,CD73的Fc段结合Fc受体而引起的免疫效应对控制肿瘤转移起到重要作用[5]。但值得注意的是,目前临床在研的CD73单抗如MEDI9447(AZ/Medimmune)和BMS-986179(BMS)去除了Fc段(下文介绍),笔者猜测这可能是为了降低潜在的副作用,扩大治疗窗口。
除了抗体外,也有公司在开发CD73小分子抑制剂。Arcus Biosciences的CD73抑制剂AB680开发了静脉和口服两种剂型,在啮齿类动物模型中体现了良好的选择性、安全性和有效性,目前接近IND申报。GSK已为其开发的氢氯噻嗪衍生物申请了CD73抑制剂专利。如果能进一步证明细胞内的CD73也有重要的促癌活性,则小分子CD73抑制剂是有一定竞争优势的。
靶向CD73的临床研究
由于靶点机理明确,且临床前研究结果显著,目前全球已有十多家企业在开发CD73抗体药物,其中BMS,AZ/MedImmune,Novartis/Surface Oncology,Corvus四家的项目已进入临床早期阶段,详细信息见表2。
表2.临床在研CD73抗体单药或组合疗法[1]

通过表2不难发现,CD73针对实体瘤治疗的研究重点在于其与PD-(L)1单抗和/或A2AR抑制剂联用的疗效和安全性。CD73与PD-(L)1的协同效应已在临床前研究中获得证明[6],现在需要在临床试验中进一步确证。而A2AR作为CD73下游结合腺苷并启动免疫抑制反应的关键受体,与CD73单抗的临床联用效果也值得期待。
2018年AACR年会上,研究人员公布了BMS-986179的I期临床初步结果。数据显示,截止2017年12月19日,共有59名患者接受了BMS-986179单药或与Nivolumab(O药)联用的治疗,7名患者获得部分缓解(Partialresponse,PR),另有10名病情稳定(Stable disease,SD),联合疗法的安全性与Nivolumab单药一致[7]。
展望
CD73是一个新兴的肿瘤免疫靶点,与肿瘤的发生发展、转移、不良预后密切相关。临床前研究也充分证明CD73可以促进肿瘤的免疫逃逸,靶向CD73的药物(尤其是抗体药)可以遏制肿瘤发展转移,并能与PD-(L)1单抗和/或A2AR抑制剂联用产生协同效应,早期验证性临床试验正在进行中。
从肿瘤微环境的特点和获得性耐药的机理而言,CD73还有潜力与更多的治疗策略联用,如放化疗、CTLA-4单抗,过继细胞治疗等,当然这些都需要临床试验的验证。
要点
- CD73是一种表达于免疫细胞、癌细胞表面的核苷酸酶,能够分解AMP生成腺苷
- CD73-腺苷信号可以促进肿瘤微环境的免疫抑制效应,并与多种实体瘤的不良预后密切相关
- CD73抗体在临床前模型显示积极疗效,已有多个项目进入早期临床研究
- CD73抗体有潜力与PD-1/PD-L1单抗、放化疗、过继细胞疗法等联合使用
