来源:癌度医学部
2018年初,美国药监局批准诺华公司生产的创新性抗癌药 Lutathera(镥氧奥曲肽)上市,用于治疗成人生长抑素受体阳性的胃肠胰腺神经内分泌肿瘤。
这是美国药监局正式批准上市用于治疗神经内分泌肿瘤的放射性药物。
1、什么是PRRT(Lutathera)?
2、Lutathera疗效如何?
此次获批是基于NETTER-1 III期研究:该药对中肠神经内分泌肿瘤患者的疗效观察。
背景:
由于肿瘤本身和激素相关症状,神经内分泌肿瘤的进展与生命质量的下降有关。
III期随机对照NETTER-1试验比较了晚期恶性肠神经内分泌肿瘤患者接受177 Lu- Lutathera(177Lu; Lutathera)与高剂量(60mg)奥曲肽LAR对照治疗的疗效。
结果:
在某些时间点,在177Lu组与奥曲肽LAR对照组中观察到在包括患者总体健康状况和腹泻等关键生存质量方面有显著临床和统计学改善。
平均来说,177Lu组患者的总体健康状况改善28%,奥曲肽LAR对照组患者的健康状况改善15%,177Lu组奥曲肽LAR对照组患者的总体健康状况恶化分别为18%和26%。
结论:
生活质量分析表明,晚期肠神经内分泌肿瘤患者中与高剂量奥曲肽相比,177Lu治疗除了在已经报道的无进展生存期方面有显著改善外。
在某些重要的生活质量方面也有优势,进一步证实了177Lu对患者生活质量改善的治疗价值!
3、基于Lutathera的新疗法-PRRT
生长抑素受体亚型2(SSTR2)表达的肿瘤包括胃肠胰神经内分泌肿瘤、肺神经内分泌肿瘤、嗜铬细胞瘤、副神经节瘤、神经母细胞瘤、甲状腺髓样癌和非嗜碘性甲状腺癌。
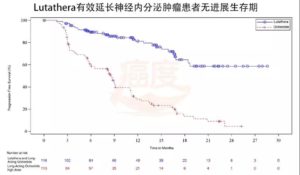
NETTER-1研究显示,与60mg奥曲肽LAR组相比,使用LUTATHERA®(PRRT)治疗的中肠神经内分泌肿瘤患者的疾病恶化或死亡风险降低了79%。
LUTATHERA®组的中位无进展生存期尚未达到,而60mg奥曲肽LAR组的中位无进展生存期为8.5个月。
预先计划的中期总体生存分析表明,与60mg奥曲肽LAR相比,LUTATHERA®治疗将预计死亡风险降低48%。
在欧洲、澳大利亚和北美地区,PRRT被认为是患者初始奥曲肽LAR治疗失败后的有效疗法。

如上图所示,一项发表在国际著名癌症期刊的研究显示,PPRT能够显著提高疾病生存期。
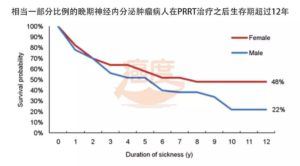
一项随访12年的研究报道,肽受体放射性核素疗法(PRRT)治疗后,32%的转移性或不可手术的病人在12年后仍存活。
不过这项随访发现女性病人更可能从治疗获益,也就是生存期超过12年的女性病人比男性病人多。
4、PRRT的治疗优势有哪些?
5、PRRT适应症和禁忌症
该药的绝对禁忌症:由于该药具有放射性,因此对于一些病人是禁用的,如怀孕、严重急性伴随疾病、严重不可控的精神疾病,以及预期生存期小于3个月的病人。
相对禁忌症是哺乳(如果不中止)、未纠正的类癌性心脏病的病人等。
PRRT是用核素Lu177与前标记物结合,靶向到达指定位置而达到放疗效果,适应症是在中晚期转移性神经内分泌肿瘤,且化疗治疗耐药后的情况下使用。
欧洲ESMO指南明确了该药的治疗地位,美国FDA批准了PRRT在消化道神经内分泌癌中的使用。
目前国内北京大学肿瘤医院、南京第一医院等正在进行 临床试验招募 ;亚洲范围内新加坡中央医院、马来西亚双威医疗中心已经实践多年。
参考文献:
1、Strosberg J, Wolin E, Chasen B, et al. Health related quality of life in patients with progressive midgut neuroendocrine tumors treated with 177Lu-Dotatate in the phase III NETTER-1 Trial. JCO 2018.
2、Gabriel M,et al., Twelve-year Follow-up after Peptide Receptor Radionuclide Therapy (PRRT).J Nucl Med. 2018 Aug 16.
