来源: 无癌家园
打一针疫苗便可让全身癌细胞消退,这是所有癌症患者及其家属的梦想,也是医护研究人员的梦想,那么这个梦想会实现么?这个癌症疫苗到底发展到哪一步了呢?
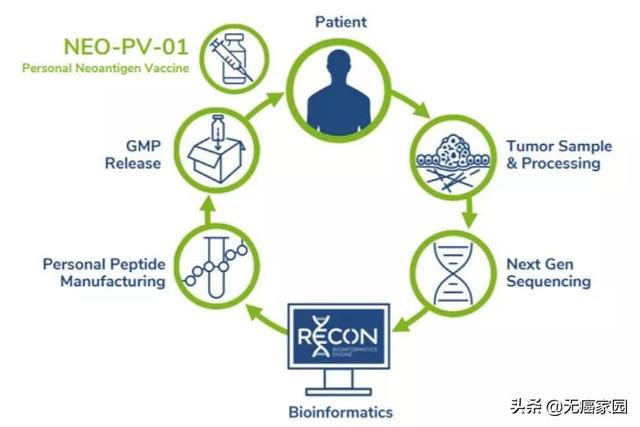
NEO-PV-01是 Neon Therapeutics公司研发的一种个体化新抗原疫苗,是根据每个患者的独特突变定制设计和制造的。 其设计包括多达20种新抗原靶向肽,旨在产生抗肿瘤免疫应答,指导T细胞靶向患者肿瘤中的特定癌症新抗原。
打一针疫苗便可让全身癌细胞消退,这是所有癌症患者及其家属的梦想,也是医护研究人员的梦想,那么这个梦想会实现么?这个癌症疫苗到底发展到哪一步了呢?
NEO-PV-01是 Neon Therapeutics公司研发的一种个体化新抗原疫苗,是根据每个患者的独特突变定制设计和制造的。 其设计包括多达20种新抗原靶向肽,旨在产生抗肿瘤免疫应答,指导T细胞靶向患者肿瘤中的特定癌症新抗原。
与化疗和放疗相比,癌症疫苗通常不会产生严重的副作用,与直接杀死肿瘤细胞和体内正常快速分裂细胞的化疗和放疗不同,癌症疫苗和其他免疫疗法是通过刺激机体免疫系统而发挥其抗癌作用的,仅针对肿瘤细胞,减少副作用的发生。
鉴于这些特征,癌症疫苗为癌症患者提供了一种更有针对性、更温和的癌症治疗方法,这种方法对身体的危害要小得多,并且患者有希望获得更好的生活质量。
癌症疫苗的分类
目前,已经上市的癌症疫苗有两类,一种是预防性疫苗,如HPV宫颈癌疫苗。
另一种是治疗性疫苗,如Provenge(sipuleucel-T),这是全球首个也是目前唯一一个获得美国FDA批准的癌症疫苗,治疗转移性前列腺癌,临床研究发现,该药物延长患者平均生存时间为至少4个月,这开创了癌症免疫治疗的新时代。
另外,古巴批准了两种肺癌疫苗,分别是一代疫苗CIMAvax-EGFR和二代疫苗Vaxira;日本融合细胞疫苗也已经获得厚生劳动省的认可,用于各种实体瘤的治疗;日本厚生劳动省官方宣布将 DC免疫疗法列入 A 级先进医疗技术,并已用于上万例晚期癌症病症的临床治疗;德国政府认可的DC 细胞制备实验室,运用 DC 免疫疗法已累积治疗数千名患者。
但是,由于种种原因及局限性,这些疫苗并没有在全世界得到广泛使用。
随着科学技术的不断进步,多种癌症疫苗已经逐渐进入临床,根据不同的技术原理,癌症疫苗又可以分为:
- 树突细胞(DC)癌症疫苗
- 重组癌症疫苗
- 抗原/佐剂癌症疫苗
- 全细胞癌疫苗
- 病毒载体和DNA癌症疫苗
下面,小编将为您盘点一下目前技术比较成熟且已经取得重大进展的癌症疫苗。
肺癌疫苗
肺癌疫苗的想法听起来很荒谬。毕竟,肺癌不是流感。但是,古巴研究人员25年的研究,使这种治疗型肺癌疫苗现在已经成为现实!早期的试验表明,这种治疗方法可以帮助60岁以下的晚期肺癌患者平均比未接种疫苗的患者长11个月!
非小细胞肺癌疫苗CIMAvax在古巴和其他国家已经进行了大量的临床试验,但美国的试验目的是要疫苗联合PD-1是否更有效,能否加速免疫系统的反应,这是第一次尝试进行联合治疗。
PD-1抑制剂纳武单抗是目前全球研究最热的抗癌药物之一,是一种能引发自体免疫对抗癌症的抗体,在美国已经成为非小细胞肺癌患者的标准治疗方案,目前已在中国上市并销售。
2018年1月,美国第一组经过初始化疗的晚期肺癌患者开始进行CIMAvax疫苗联合PD-1(Opdivo,纳武单抗)治疗。研究人员Pedro Camilo Rodríguez说,这是一种非常创新的方法,对我们来说,疫苗是一项突破性的成就。
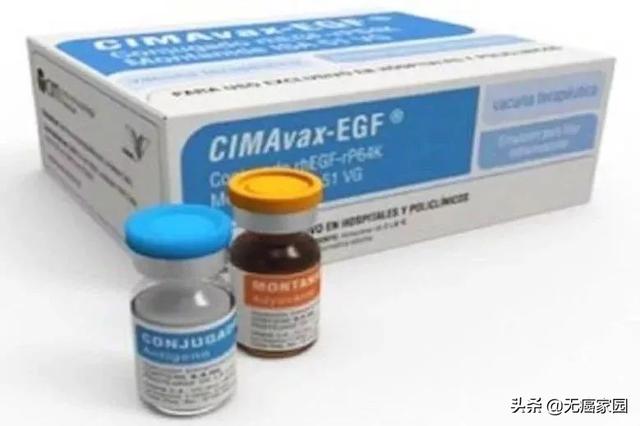
全球首个注册用于晚期非小细胞肺癌的疫苗–CimaVax
近日,罗斯威尔公园综合癌症中心胸部肿瘤科主任,首席研究员Grace Dy医学博士宣布根据第1阶段/第2阶段试验的第一部分的积极结果,肺癌疫苗CIMAvax-EGF进入第二阶段临床试验,将研究这种组合方法作为晚期肺癌患者维持治疗的生存益处。
但是注意,CimaVax EGF不能阻止癌症的发展,更不能治愈癌症。而是启动了一种机制,通过这种机制,癌细胞的失控生长和分裂更加受到限制,从而将晚期侵袭性肺癌转变为慢性疾病。目前,古巴肺癌疫苗已经在全球80多个国家获批,国内患者也可以申请从海外购买该疫苗(400一626一9916)。
树突细胞疫苗
——针对全部实体瘤
在人体血液系统中,存在一种对于人体的免疫系统起着至关重要作用的免疫细胞,即树突状细胞(Dendritic Cell,又称DC细胞),占总体免疫细胞的1%。DC细胞是人体内功能最强的抗原递呈细胞,如果免疫系统中,没有DC细胞携带抗原得T细胞,免疫细胞无法自行找到侵袭人体的异物(病毒、细菌、癌细胞),人体的免疫功能将大打折扣。
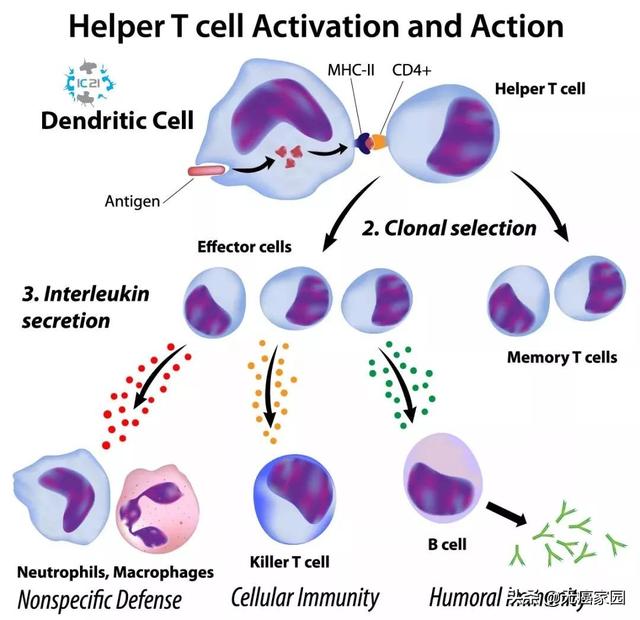
DC细胞的抗原递呈作用处于免疫系统中心环节,不仅能通过抗原递呈作用来教育幼稚T细胞成为抗原特异性细胞毒性T细胞(CTL), 还可与机体其他的免疫细胞如NK细胞、NKT细胞及B细胞相互作用,激活免疫系统,识别并杀伤肿瘤。
树突细胞工作原理
DC细胞作为关键的抗原递呈细胞,其主要作用是识别并吞噬肿瘤或病毒抗原,经加工后将抗原传送至DC细胞膜表面。随后,携带抗原信息的DC细胞与幼稚型T细胞接触,将抗原信息传递给T细胞,刺激T细胞活化并扩增,产生大量的特异性识别肿瘤细胞或病毒感染细胞的T细胞。T细胞是细胞免疫主力军,占比免疫细胞58%。
树突疫苗制备流程
树突疫苗制备流程简单方便,仅需抽取30ml外周血,通过提取并纯化单个核细胞,加入诱导因子,诱导并培养树突状细胞(DC),诱导DC细胞(树突状细胞)成熟并大量增殖。
培养完成后,注射人体后将会迁移到淋巴组织中并将肿瘤抗原信息递呈给下一级T淋巴细胞,形成肿瘤抗原特异性细胞毒T淋巴细胞(CTL),CTL随着血液循环到达身体各处攻击癌细胞,实现抗癌功能。
树突疫苗理论上可以对应任何阶段的癌症,包括术后恢复慢,且害怕隐匿性癌细胞没有被彻底根除的患者;可以辅助放化疗,提高机体T细胞的抗肿瘤能力,提高生活质量,延长生存期。
树突疫苗临床试验
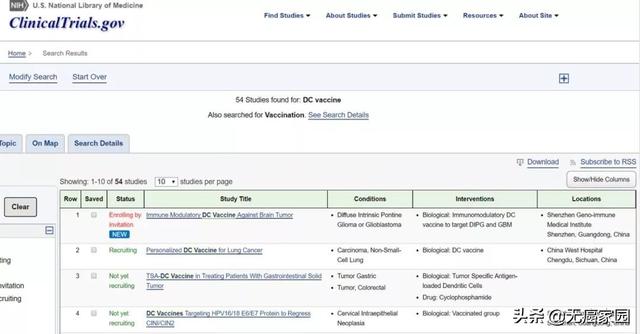
临床中正在开展许多针对癌症的治疗性疫苗接种途径。在国际临床试验官网clinicaltrials.gov中搜索术语树突细胞疫苗,有54个临床研究。这些研究中的一个共同特征是疫苗接种的关键步骤是将癌抗原有效呈递给T细胞。
因为DC是最有效的抗原呈递细胞,因此,利用它们的多样性可能产生改进的治疗性疫苗,通过400一626一9916了解更多DC疫苗信息或者参与临床试验。
融合细胞疫苗
——针对全部实体瘤
我们知道免疫系统在清理肿瘤细胞时,细胞毒性T细胞(CTL) 负责攻击癌细胞,而树突状细胞(DC)负责递呈给CTL癌细胞的抗原信息,二者相互配合,密切合作来完成杀瘤大业。DC细胞相当于信号兵,把搜索到的癌症信息传递给助理部队(CTL细胞),CTL部队根据情报来杀癌细胞。
融合细胞疫苗是对目前的DC-CTL疗法进行改良,现在可以使癌细胞携带的多种癌抗原成为免疫系统的攻击目标,特异性更强。经过改良的融合细胞疗法就是能够让全部的肿瘤细胞抗原全部送到CTL面前,技术原理是这样的。
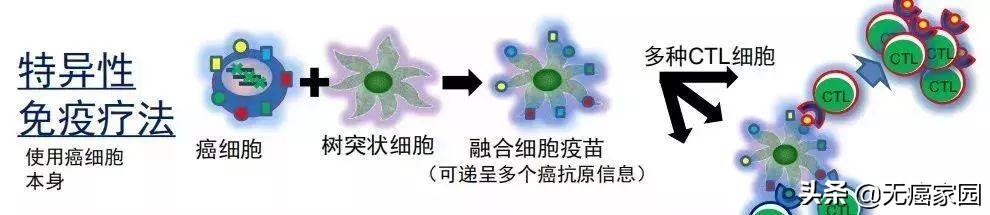
融合细胞疫苗治疗原理
改良前的的DC-CTL疗法是在体外提取癌细胞的抗原(不是全部的癌抗原,仅为一些常规的抗原),再用抗原刺激体外诱导的DC细胞,使其携带抗原信息,去递呈给CTL细胞,让其具有识别癌细胞的能力,进而杀伤癌细胞。但是,DC细胞细胞获取的抗原信息比较有限,会使得一部分癌细胞无法被识别出来。
而改良后的融合细胞技术,是将整个癌细胞与DC细胞进行融合,全部癌症抗原信息均递呈给DC细胞。形成的融合细胞具有癌细胞的抗原性,又具有DC细胞的递呈功能。所以,融合后的细胞可以携带着全部种类癌抗原找到CTL细胞,“告知癌细胞就是长这样的,”使其具有癌细胞的识别与杀伤能力。
融合细胞疫苗制备简单方便
大家应该了解到融合细胞的制备必须要有两种细胞,一种是树突状细胞(DC),一种是肿瘤细胞。如何进行治疗请400-626-9916了解。
1.准备树突状细胞,抽取肿瘤患者外周血50-60ml,诱导树突状细胞。
2.准备癌细胞,可以提供新鲜肿瘤组织,或提供组织切片提取肿瘤DNA,通过基因工程技术加工成具备肿瘤抗原信息的成纤维细胞。
3.进行DC细胞与癌细胞(或成纤维细胞)融合。
4.融合细胞疫苗接种,接种至患者淋巴结丰富的部位,发挥抗肿瘤活性。
新型病毒载体和DNA癌症疫苗
美国一对科学家夫妇研制出一种新型的癌症疫苗,名为ImmuneFx(IFx),不是保护人体免受癌细胞快速突变的预防性疫苗,而是将基因和细胞疗法相结合,开发出来的一种“治疗性”疫苗。
由这对夫妇科学家设计的“ ImmuneFx ”治疗性疫苗是直接注射到肿瘤中,从而迫使癌细胞在其表面表达特定的细菌抗原,免疫系统能够轻易识别这种细菌抗原,使得T细胞能够有效进攻肿瘤细胞。也就是说,注射疫苗之后,激活机体免疫系统,使其在全身破坏肿瘤细胞而不伤害健康的细胞和组织。
高科技:利用基因工程技术制备质粒DNA疫苗
ImmuneFx疫苗的治疗原理是,在体外通过基因工程技术来制备一种质粒DNA疫苗(化脓性链球菌emm55基因(pAc / emm55)),将疫苗患者的肿瘤细胞中,质粒DNA有个特点就是可以在宿主细胞(肿瘤细胞)中表达携带的基因,emm55是一种酿脓链球菌血清分型抗原,也就是说在肿瘤细胞能表达一种细菌抗原,肿瘤细胞因此被标记上,而免疫系统对这个细菌抗原特别敏感,可以迅速识别并调动机体的免疫细胞进行杀灭。
*~*
总结
五十年前,麻疹,腮腺炎和风疹疫苗的开发挽救了许多生命。
越来越多的新型疫苗已经步入临床试验阶段,在随后的试验中,个体化疫苗将被用于各类癌症,拥有足够数量的新抗原接种疫苗具有巨大潜力。
并且,大量研究证实了癌症疫苗的可行性,相信未来随着更多临床研究实验的开展跟进,癌症疫苗将会在癌症治疗方面发挥重要作用,离我们打一针就让肿瘤君滚蛋的梦想也就越来越近。
