胆固醇在动脉粥样硬化(AS)中的作用已经毋庸置疑。血循环中的LDL突破内膜进入血管壁,是AS的早期事件和启动因素。传统观点认为,LDL是被动的穿过受损的血管内膜浸润到血管壁的(Fig 1. A)。
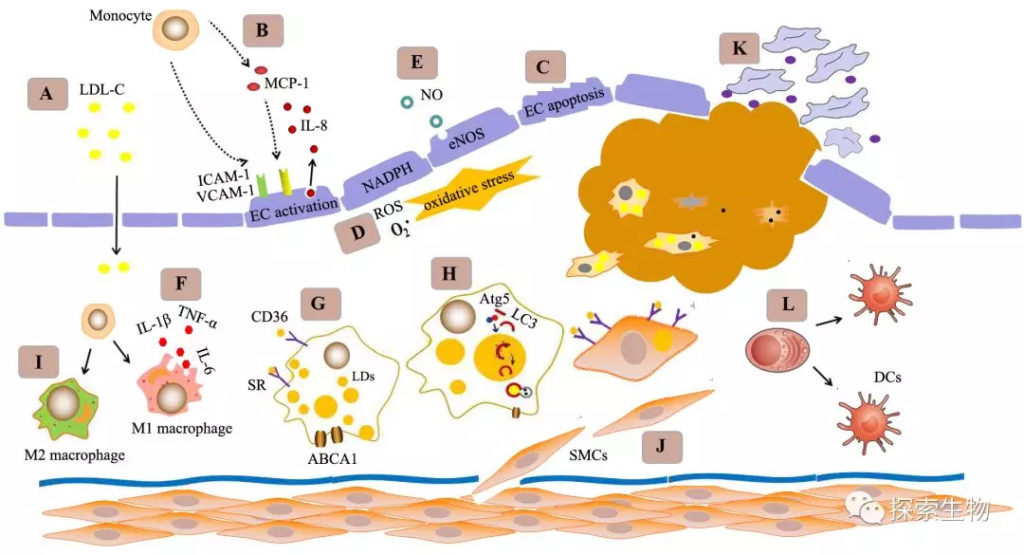
Fig 1. 传统观点认为,由于各种因素(如血流动力学改变、炎性因子、脂质等)导致血管内皮发生凋亡/损伤,或者增殖修复能力减弱,进而引起内膜通透性增加,血循环中的LDL由此穿透内膜(或内膜间隙)进入血管壁(过程A)。图片来自参考文献 [1]。
然而,Nature最近的这篇报道,完全推翻了内科书上公认的观点:LDL并非被动浸入内膜下,而是通过与内皮细胞上的SR-B1受体结合,主动转运到内膜下。内皮细胞SR-B1敲除小鼠动脉泡沫细胞和斑块明显减少 [2]。
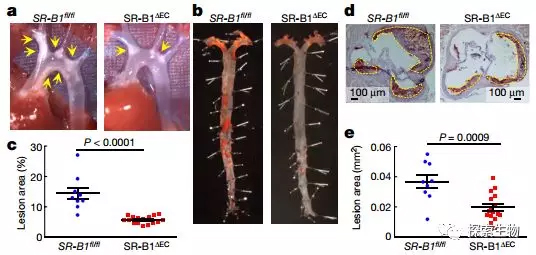
Fig 2. 可以看到,与对照组(Apoe−/−SR-B1(fl/fl))相比,SR-B1敲除小鼠(Apoe−/−SR-B1(∆EC )小鼠斑块减轻程度非常明显。
通过给小鼠静脉注射DiI标记的LDL(DiI-LDL),发现SR-B1敲除小鼠血管壁中脂蛋白的含量明显减少。这说明了SR-B1介导了脂蛋白从血循环到血管壁的跨细胞运输。同时他们进一步证明了SR-B1的C末端胞质尾部的氨基酸487-494(IQAYSESL)对内皮细胞摄取LDL和转胞吞作用至关重要。
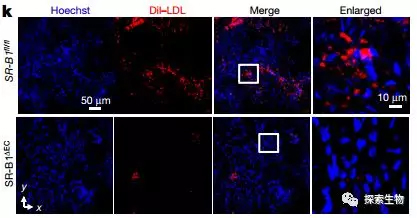
Fig 3. 上为对照组,下为SR-B1敲除组。
由于SR-B1缺乏内化作用的蛋白序列Tyr-X-X-θ,因此SR-B1对LDL的转胞吞作用肯定还需要“助手”。他们发现,一旦SR-B1摄取了LDL,就会募集DOCK4,DOCK4负责SR-B1和LDL的结合完成内化作用,但是DOCK4对LDL的摄取无影响。因此,内皮细胞SR-B1和DOCK4对LDL的转运过程均是不可或缺的。
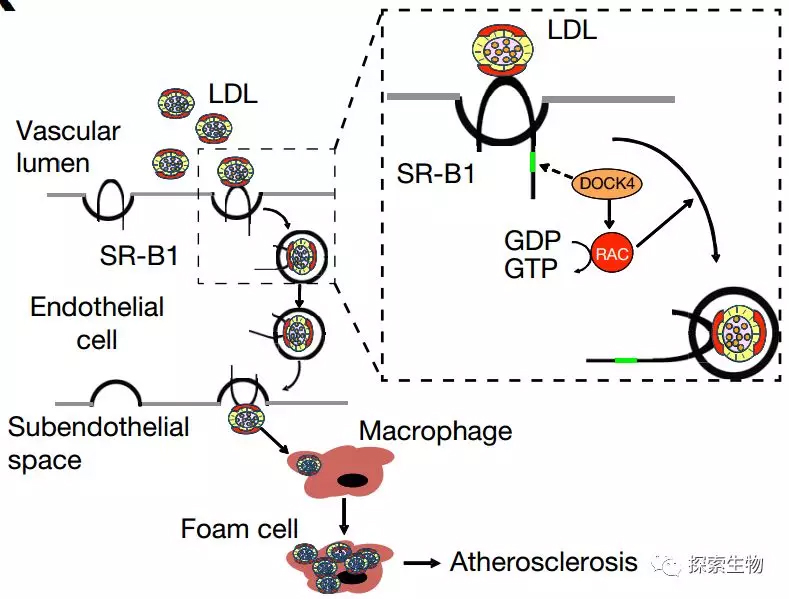
Fig 4. SR-B1介导LDL转运穿过内皮,并被巨噬细胞吞噬形成泡沫细胞。LDL与SR-B1的质的C末端氨基酸487-494(IQAYSESL)结构域结合,然后募集DOCK4,DOCK4通过促进LDL与SR-B1的偶联结合促进SR-B1的内化和LDL的转运。
正如篇头所述,在动脉粥样硬化研究领域,不乏各种研究热点,如自噬、炎性小体、circRNA、LncRNA、外泌体、肠道菌群等,而且每隔两三年就会蹦出新的研究热点,虽然由此带来的高分文章源源不断,但是小编对于这样的科研感到渺茫,因为这些研究很难转化为某种治疗药物。高昂的科研经费催出了高分的文章,却没有推动医学的发展。作为一名临床医学专业的学生,小编目光一向短浅和局限,认为如果科研不能转化为某种药物或者治疗手段,其意义真的不大。自从上个世纪七八十年代的他汀问世以来,在冠心病治疗领域,再也没出现像样的突破性研究(不好意思,扯远了)。
Than, why?
动脉粥样硬化(AS)是一个复杂的过程,涉及到多种细胞的多种生理病理过程,如单核-巨噬细胞,平滑肌细胞,内皮细胞,T细胞,肥大细胞….,这里面又交汇着炎症、凋亡、自噬、增殖迁移、血管生成、脂质代谢等多种过程,乱的真像一锅糊了的粥。无论怎样,血管内皮的变化是AS的起始,一旦脂质开始在内膜下沉积,便触动了多米诺骨牌的开关,整个过程便变的复杂而且难以逆转。这可能也是针对上述各种细胞的体外或体内实验,即使取得了欣喜的结果,也难以应用到临床的原因。周而复始,研究变成了画大饼。总之,缺乏特定的靶点,便难以转化为药物。因此,只有从源头(内皮)阻止AS过程,才有望取得突破。然而,以往认为,脂质是被动的穿过受损的血管内膜浸润到内膜下的,这种模糊的过程是最令人厌恶的,就像医生给你诊断个什么什么综合征,却告诉你没有很好的药物。
写到这里,越发对当前的这篇研究推崇备至,实用而且接地气。这篇研究不仅明确了LDL进入血管壁的方式,还给出了特点的靶点——SR-B1。而针对受体进行药物设计是最容易成功的手段之一,就像目前火热的肿瘤免疫治疗药物PD1/L1和CTLA-4。设计特定SR-B1封闭抗体或者抑制剂,均有望转化为治疗冠心病的新药物。
鉴于小编的无知,小编认认真真查阅了SR-B1的资料,以及Philip W. Shaul等人(本研究的通讯作者,美国人)进行这项研究的“动机”。Unexpectedly, Shaul PW竟然也是站在巨人肩膀上取得了成功。早在2015年,杂志Cardiovasc Res便发表了加拿大多伦多大学题为“A novel assay uncovers an unexpected role for SR-BI in LDL transcytosis”的研究[3],正如题目中的unexpected一样,这篇研究意外的鉴定出了SR-B1介导 LDL transcytosis的特殊作用,并也通过SR-BI敲基因小鼠得到了验证。实在不明白为什么这样首创的突破性研究只发了一个6分多的杂志(难道也是学生为了着急毕业?),而后面的研究则发了Nature….这也说明了看文献不能挑肥拣瘦,高分文章很可能是建立在前期低分文章基础之上的。
同时,鉴于SR-B1只是清道夫受体(scavenger receptor)家族的一个小成员,小编本想继续搜集一下其他SR的作用(以及SR-B1的其他作用),但是小编今天身体有恙,请看下章分解吧。
同时,我们期待SR-B1的后续研究,争取早日为全世界的冠心病患者带来福音。
原创: 石头 | 探索生物
参考文献
1. Qiao L, Chen W. Atheroprotective effects and molecular targets of bioactive compounds from traditional Chinese medicine. Pharmacol Res. 2018 Sep;135:212-229.
2. Huang L, Chambliss KL, et al. SR-B1 drives endothelial cell LDL transcytosis via DOCK4 to promote atherosclerosis. Nature. 2019 Apr 24. doi: 10.1038/s41586-019-1140-4.
3. Susan M. Armstrong, et al. A novel assay uncovers an unexpected role for SR-BI in LDL transcytosis. Cardiovasc Res. 2015 Nov 1; 108(2): 268–277.
