![]()
嵌合抗原受体(CAR)T细胞对B细胞恶性肿瘤的有效性已得到证实。2017年10月和2018年5月,FDA先后批准axicaptagene ciloleucel和tisagenlecleucel用于≥2线治疗的大B细胞淋巴瘤的治疗,30%~40%患者可获持续解解,但因其毒性作用需住院治疗。美国Chow教授在BLOOD杂志发文,对现有弥漫大B细胞淋巴瘤(DLBCL)CAR-T细胞治疗数据进行了回顾,主要涉及axicaptagene ciloleucel、tisagenlecleucel和lisocabtagene
Maraleucel三种产品。
背景
弥漫性大B细胞淋巴瘤(DLBCL)及其它侵袭性B细胞恶性肿瘤严重危及生命,化疗敏感且身体状态尚可的患者可进行高剂量治疗后自体干细胞移植(ASCT),少部分患者可获长期缓解,但大部分患者最终因疾病死亡。CAR-T细胞疗法的问世为包括复发/难治(R/R)DLBCL在内的B细胞恶性肿瘤患者带来了新希望。
抗CD19 CAR-T细胞疗法的结构与生产
CAR-T细胞治疗包括采集患者T细胞、筛选并活化T细胞、转导抗CD19 CAR基因、体外扩增修饰后T细胞、最后将其回输入患者体内等过程。输注细胞前应行去除淋巴细胞化疗,便利内源性细胞因子促进CAR-T细胞扩增增殖。细胞输注应在有HSCT经验的中心进行,便于处理包括细胞因子释放综合征(CRS)和神经毒性(NT)在内的毒性。
二代CAR-T细胞包括胞外抗原识别区和胞内T细胞信号区,前者含有能识别特异性肿瘤抗原(如CD19)的免疫球蛋白单链可变区片段和穿膜区,后者含有T细胞活化区亚单位CD3ζ和共刺激区(CD28或4-1BB)。表1列出了3种二代CD19 CAR-T细胞治疗的关键特征,这些特征可能与CAR-T细胞体内扩增、毒性变化和克服疾病耐药有关。
表1 构成、有效性和安全性比较
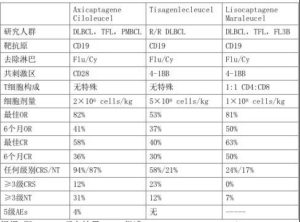
根据II期ZUMA-1研究结果,FDA批准axicaptagene ciloleucel(axi-cel,YescartaTM)治疗R/R淋巴瘤。Axi-cel成为首个用于而线治疗后的DLBCL、转化的滤泡淋巴瘤(TFL)、原发纵隔大B细胞淋巴瘤(PMBCL)和高级别B细胞淋巴瘤等疾病的抗CD19 CAR-T细胞疗法。
ZUMA-1研究纳入101例难治性DLBCL、TFL和PMBCL,接受2×106 CAR-T/kg治疗。淋巴去除治疗为环磷酰胺500mg/m2和氟达拉滨30mg/m2共3天,细胞采集和回输间期(中位17天)无桥接化疗。中位随访15.4个月,总治疗反应率(ORR)达82%,完全缓解(CR)达58%,早期CR者表现为持续缓解,预期无进展生存(PFS)达41%,中位总生存尚未达到。
Tisagenlecleucel(KymriahTM)用于治疗二线治疗后的DLBCL、TFL和高级别B细胞淋巴瘤,同时还被批准用于治疗≤25岁R/R前体B细胞急性淋巴细胞白血病。Schuster首次报道了38例R/R CD19+NHL的治疗结果,患者接受中位5.79×106 CAR-T/kg治疗。淋巴去除方案按医师各自习惯,细胞采集和回输间期中位39天,期间允许桥接化疗。中位随访28.6个月,DLBCL的ORR为50%,CR达43%。
Tisagenlecleucel的获批基于JULIET研究。该研究纳入27个国家147例难治DLBCL和TFL患者,ORR和CR分别为53%和40%,反应时间3-6个月,中位治疗反应持续时间和OS尚未达到,6个月时无复发可能性74%,转化为40%患者无疾病进展。
Lisocabtagene maraleucel(JCAR017)含有特异的CD4+:CD8+T细胞比例,使用时采用固定剂量。正在进行的I期TRANSCEND研究招募了R/R DLBCL、PMBCL、FL3B和套细胞淋巴瘤等患者,剂量水平1(DL1)5×107和DL2 1×108 CAR-T细胞作为研究剂量。淋巴去除方案为环磷酰胺300mg/m2和氟达拉滨30mg/m2共3天。68例患者的最佳ORR和3、6个月的ORR分别为75%、49%和40%,最佳CR率和3、6个月CR率分别为56%、40%和37%。
安全性
⇒ 细胞因子释放综合征
细胞因子释放综合征(CRS)的特征性表现为发热、低氧、低血压、少部分发生多器官功能衰竭或噬血淋巴组织细胞增生等。CAR-T细胞与其靶抗原结合后,T细胞活化促进细胞因子释放,介导CRS发生。CRS通常发生于治疗后1周内,1-2周达顶,但不同产品可能有所差异。ZUMA-1、JULIET和TRANSCEND研究显示,axi-cel、tisagenlecleucel和JCAR017所致CRS的中位发生时间分别为2、3、5天,≥3级CRS发生率0-23%。
CRS分级应按照Lee的标准,并根据严重程度决定治疗,包括支持治疗和全身糖皮质激素。需注意的是,Lee分级标准每级的严重程度多高于NCI CTCAE分级,而JULIET研究中采用的是Penn分级系统,因此对3项研究进行交叉比较非常有挑战,主要因为未采用统一分级标准,同时激素和抗IL-6治疗的使用和使用时机也各自不同。
⇒ 神经毒性
神经毒性指CAR-T细胞相关脑病综合征,其发生机制尚不明确,有假说认为与炎症性细胞因子弥散穿过血脑屏障(BBB)、CAR-T细胞的直接CNS毒性、BBB内皮功能异常有关。症状可轻微(嗜睡、意识混乱)或严重(失语、脑病、惊厥和脑水肿)。治疗应取决于严重程度,包括支持治疗和ICU水平的治疗,如抗癫痫、激素、对癫痫和脑水肿的特殊干预。
不同产品的NT也有所差异,ZUMA-1、JULIET和TRANSCEND研究中≥3级NT分别为31%、 12%和7%,分别有43%和27%、15%和11%、12%和16%患者接受了托珠单抗和激素治疗,上述毒性均需要有经验的中心处理。其它并发症包括感染、血细胞减少和B细胞再生不良等。表1比较了3种产品的有效性和安全性。
⇒ 抗CD19 CAR-T细胞治疗的临床应用
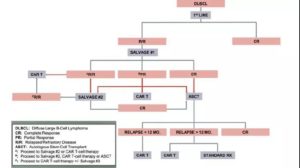
DLBCL至少有三种情况需考虑CAR-T细胞治疗,要求患者ECOG 0-1,无严重并发症,无CNS疾病史(惊厥、出血、痴呆和缺血)。挽救性含铂化疗后高剂量治疗和ASCT仍是适合移植的R/R患者的可接受治疗,但只有一半患者满足治疗要求,其中50%化疗敏感可行移植,40%可治愈。其余患者治愈性治疗选择十分有限,图1显示了临床实践中CAR-T细胞治疗的流程。
⇒ ASCT后复发患者
通常情况下,ASCT后1年内复发DLBCL预后很差,适合CAR-T细胞治疗。Axi-cel研究显示,1年时ORR为39%,但CAR-T细胞对ASCT后超过1年复发患者的作用尚不明确,既往有数据报道中位OS为12.6月-5.9年,但这些研究中的患者数量较小。不过现有数据表明,ASCT后复发如有机会接受CAR-T细胞治疗,大部分患者有望改善长期生存结果。
⇒ 一线挽救治疗无治疗反应者
对于初次挽救性治疗后未获CR或部分缓解(PR)者而言,不应立即行高剂量治疗后ASCT。CORAL研究随访数据显示,二次挽救治疗后ORR和CR率可达47.6%和33.1%,二次挽救治疗达CR者1年OS率70%,移植后增加至88.4%。如果治疗目标是获得CR后进行移植,鉴于上述CAR-T细胞的ORR数据,在做治疗决定时可考虑CAR-T细胞。
从实践角度,无治疗反应的患者通常需要紧急治疗,此时仍可考虑三线挽救性治疗,但需根据是否获得CR来决定进行移植还是CAR-T细胞治疗。
⇒ 一线挽救治疗后部分反应者
目前对此时是否采用CAR-T细胞治疗仍存在争议。通常认为,采用含铂挽救性治疗患者中,25%表现为PR,此时适合使用CAR-T细胞。然而,回顾性研究显示,DLBCL第一次挽救性治疗获得PR后接受ASCT,3-4年的预期生存率为55%(CR者75%-85%),而且PR患者中1/3有望在二次挽救性治疗中获CR。目前缺少前瞻性研究明确CD19 CAR-T细胞在此种情况下应用是否会带来更多获益。
实践与思考
⇒ 治疗时机与后勤保障
二线治疗后,仅部分DLBCL和其它B细胞恶性肿瘤有机会接受CAR-T细胞治疗并产生治疗反应,及时转诊、患者特征、疾病特征以及后勤保障对治疗是否有效均具有重要影响。患者特征包括CNS疾病、器官功能和PS评分状态,疾病特征包括疾病进展速度和治疗的紧迫性。后勤保障对治疗也很关键,从细胞采集到回输需要2-3周时间,是否有保险也会影响治疗。ZUMA-1和JULIET研究分别有9%和33%的患者虽已入组,但却因上述原因而未能进行治疗。
⇒ 经济考虑
由于是新型治疗且费用昂贵,CAR-T细胞治疗的治疗费用补偿非常复杂,axi-cel和kymriah一次输注费用373,000美元,还不包括住院、ICU以及治疗毒性反应等费用。近期,医疗补助和医疗保险中心开始着手解决门诊治疗患者的费用问题,多数私人保险也开始予以治疗补偿,但住院治疗的标准化程序和赔付非常重要,因为商品化的CAR-T产品应用越来越广泛。
结语
抗CD19 CAR-T细胞治疗对R/R DLBCL和其它侵袭性B细胞淋巴瘤显示了很好的治疗前景,ZUMA-1、JULIET和TRANSCEND研究中ORR和CR率为50%-80%和30%-50%,axicabtagene ciloleucel(Yescarta)和tisagenlecleucel(Kymriah)并因此先后获批上市,但目前尚无头对头研究比较现有产品。未来需要更多地开展前瞻性研究,以阐明抗CD19 CAR-T细胞治疗在各种疾病状态下的治疗作用以及更早期应用的价值。产品的安全性、有效性、易使用性及治疗费用均会影响治疗选择。
![]()
