免疫新辅助治疗,正在改写早期肺癌的治疗现状,这无疑也是中国临床的新机遇
生命的价值不是由长度定义,而是由宽度和深度来衡量的,所以拓宽这两种维度也同样重要。其实这种定义标准适用的范围,还有生命之外的许多东西。
今年刚刚诺奖荣耀加身的免疫治疗,就是在以让人目不暇接的速度,飞快发展着自己的宽度和深度——一种种不断增加的适应症自然是宽度,而从治疗晚期患者到更早期更多样的用法,就是深度了。
这种深度挖掘的体现之一,就是对早期癌症患者进行的新辅助治疗探索。
“早期”,跟着的往往是“能做手术”这几个字,相信不少患者听到都会长舒一口气,比如在非小细胞肺癌中,早期通常是指临床分期I期、II期以及部分III期的患者,手术是他们最佳的治疗选择,但这些“幸运儿”只占全部患者的20-25%,并且50%的患者在手术后,仍然会出现复发甚至转移[1]。
怎么解决这样的困境呢?医学界先后提出了两种套路,一种是在手术后进行的放化疗,也就是辅助治疗;而另外一种,则是把放化疗的时间挪到手术前,就是即将谈到的新辅助治疗了。
从理论上来说,新辅助治疗可能给患者带来的获益和优势包括:
1.在手术前缩小肿瘤,降低手术难度,甚至给原本无法手术的患者手术的机会
2.提前清除掉那些肉眼不可见,但已经存在的微小转移灶,降低复发风险
3.手术前肿瘤部位的血供保持比较完整,治疗药物可以更有效的到达肿瘤处
4.患者在手术前的身体状态相对较好,能更好地耐受放化疗[2]
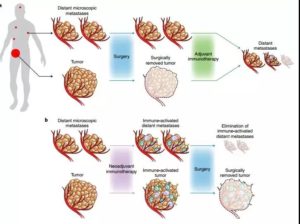
辅助也好,新辅助也好,都只能将早期肺癌患者的5年生存率提高5%
不管是辅助还是新辅助,都已经历了漫长的临床实践探索,各种各样的药物和组合方案基本都露过脸,但辅助也好,新辅助也好,都只能将早期肺癌患者的5年生存率提高5%[2-3],同时治疗的副作用发生率高,程度也很严重。
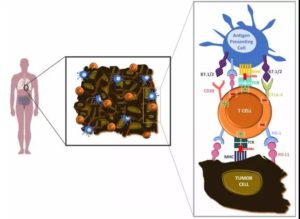
对免疫新辅助治疗来说,大肿瘤新抗原多就是目标啊
免疫治疗还可以利用手术前肿瘤体积大,新抗原多的特点,充分增强体内抗肿瘤免疫T细胞的活性,让它们分散到全身,清除微小的癌症转移灶,这比在辅助治疗时使用效果更好,优势已经在临床前期的动物实验中得到证实[5]。如果等到手术后再来做免疫治疗,随着免疫环境的变化,这些好处可能就减弱了。
从科研角度来说,免疫新辅助治疗之后再做手术,还能把手术中切除的肿瘤组织,作为进一步抗癌研究的材料。让免疫疗法担任新辅助治疗的角色,和手术可以说是强强联手,在乳腺癌和黑色素瘤的治疗中都已经有了成功的先例。
由于早期患者的预后相对较好,要是按着传统思路,以患者长期的DFS和OS数据作为评价指标,收集数据往往要等上好几年,最夸张的案例,大概是长春瑞滨新辅助治疗的ANITA试验,从患者入组到结果发表,足足过了12年[6]!
以当今医学和生命科学发展的步伐,12年都沧海桑田了,所以业内专家普遍呼吁,把病理学显著缓解作为评价新辅助化疗效果的指标。而这个显著缓解,指的是切除的肿瘤和淋巴结中,癌细胞的占比低于10%[7]。
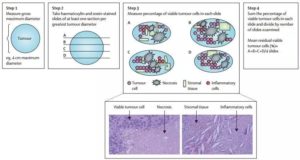

不过,手术当中看不到每一个癌细胞……
试验的主要终点,就是此前提到的病理学显著缓解,此外研究者们还对切除肿瘤的基因突变情况、患者体内的T细胞变化做了分析,毕竟免疫新辅助治疗还有许多未解之谜,能获得更多的数据肯定再好不过。
用研究主导者,约翰·霍普金斯医学院肿瘤免疫治疗研究所主任Drew Pardoll的话说,“我们都被惊呆了”。在手术完全切除肿瘤的20名患者中,9名患者的肿瘤已经实现显著病理学缓解,甚至有两例肿瘤中完全见不到癌细胞!
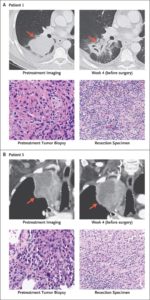
肉眼可见的改变!
新辅助治疗的安全性也非常好,并没有因为副作用导致手术延期。从手术后的随访来看,20名患者中只出现了3例复发,随访18个月时,患者整体的PFS率是73%,这可比历史数据50%的复发率[9],好看多了。
而手术前使用O药,确实调动了患者体内的T细胞进入抗肿瘤免疫状态,病理切片也证实,大量的T细胞和巨噬细胞浸润到了肿瘤当中。患者的肿瘤突变负荷(TMB),则有望作为预估疗效的生物标记物[10]。

基本上呈现的是一种线性关系,突变多疗效就好
O药配合起现有的新辅助化疗方案,效果就更上一层楼了。在前不久的世界肺癌大会(WCLC)上,专门针对IIIA期肺癌患者的NADIM试验初步结果被公布,用四个字来概括就是:史无前例。
这项在西班牙开展的试验目前共入组了46名患者,在手术前使用O药+卡铂+紫杉醇的方案,进行三个周期的新辅助治疗。而已经做完手术的30名患者里,有24名实现了病理学显著缓解,其中18名是完全缓解!
虽然由于试验开展较晚,试验患者的PFS时间、生存期等指标还没成熟,但NADIM试验80%的病理学显著缓解率,已经是化疗时代最好数据的三倍[11]。
三倍!Respect,Respect,Respect!
当然,O药的对手们也不会错过新辅助治疗这个大舞台,比如罗氏的PD-L1单抗Tecentriq,它的单药治疗试验LCMC3,设计就与此前提到的O药单药治疗非常相似,入组患者也更多,但病理学显著缓解率只有22%[12]。
在联合同样的卡铂+紫杉醇,进行两个周期的新辅助化疗时,Tecentriq的病理学显著缓解率提升到了50%,也有21.3%的完全缓解,但数据明显没有NADIM试验好看[13]。而O药的对头K药,则没有公布过多数据[14]。
在单药治疗和联合化疗之外,免疫治疗+免疫治疗也同样是一种思路,比如O药+抗CTLA-4的伊匹单抗。NEOSTAR试验就对比了联合免疫方案与O药单独使用三个周期的效果,不过31%的病理学显著缓解率似乎低于预期[15]。
战火才刚刚被点燃,一切还有待临床III期试验的考验,鹿死谁手,犹未可知。
生存期获益有限,缺乏预估疗效的手段,治疗副作用导致手术延期,甚至治疗无效使患者失去手术机会,这些问题,都让化疗新辅助治疗的发展之路逐渐停滞。而现实的困境,就是免疫新辅助治疗破局的方向。
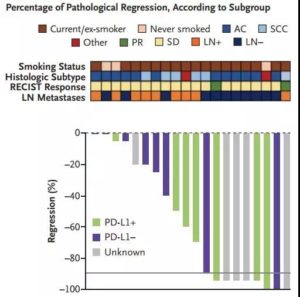
PD-L1阳性效果好,但是阴性也不差呢……
近期《自然医学》的一篇社论里,就对方兴未艾的免疫新辅助治疗提了一连串的问题:用药剂量是按体重算,还是直接定量?用药次数和时机怎么把握?怎么和化疗药物或者其他免疫药物搭配?哪些患者最适合新辅助治疗[16]?
比如用药次数和时机,新辅助治疗用几个周期才性价比最高,还不耽误手术的时间?而在免疫新辅助治疗时代,唱主角的也肯定不止PD-1/L1抑制剂们,搭配化疗药、抗CTLA-4单抗、抗血管生成药物甚至是放疗,也许都是有效的。
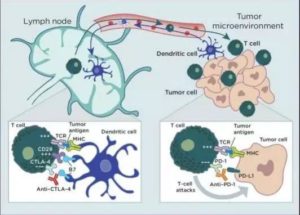
微环境里群魔乱舞,PD-1抑制剂也不一定能独撑危局
即使是有了全新的方案,试验设计也同样需要改进,比如评价疗效的方法,就不能像过去一样靠影像学的缓解标准进行,最好把T细胞亚群测定、肿瘤突变负荷这些新检查,能做的都做了才好。
而且由于新辅助治疗的试验大多在欧美开展,中国患者的数据目前几乎还是空白,这就需要国内的临床研究迎头赶上了。也许中国患者会像当年对EGFR靶向药一样,也会受益更多呢?
长风破浪会有时,直挂云帆济沧海。免疫治疗造福早期癌症患者的日子,相信不会太远了,对地平线上亮起的那缕曙光,奇点糕会翘首以待。
原创:奇点糕 奇点网
参考资料:
1.Antonia S J, Villegas A, Daniel D, et al. Overall survival with Durvalumab after Chemoradiotherapy in stage III NSCLC[J]. New England Journal of Medicine, 2018. DOI: 10.1056/NEJMoa1809697
2.Group N M C. Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and meta-analysis of individual participant data[J]. Lancet, 2014, 383(9928): 1561. doi: 10.1016/S0140-6736(13)62159-5
3.NCCN Clinical Practice Guidelines in Oncology, Non-Small Cell Lung Cancer, Version 3.2018.
4.Lavin Y, Kobayashi S, Leader A, et al. Innate immune landscape in early lung adenocarcinoma by paired single-cell analyses[J]. Cell, 2017, 169(4): 750-765. e17. https://doi.org/10.1016/j.cell.2017.04.014
5.Liu J, Blake S J, Yong M C R, et al. Improved efficacy of neoadjuvant compared to adjuvant immunotherapy to eradicate metastatic disease[J]. Cancer Discovery, 2016: CD-16-0577. doi: 10.1158/2159-8290.CD-16-0577
6.Douillard J Y, Rosell R, De Lena M, et al. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB–IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial[J]. The Lancet Oncology, 2006, 7(9): 719-727. https://doi.org/10.1016/S1470-2045(06)70804-X
7.Hellmann M D, Chaft J E, William Jr W N, et al. Pathological response after neoadjuvant chemotherapy in resectable non-small-cell lung cancers: proposal for the use of major pathological response as a surrogate endpoint[J]. The Lancet Oncology, 2014, 15(1): e42-e50. https://doi.org/10.1016/S1470-2045(13)70334-6
8.Gianni L, Pienkowski T, Im Y H, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial[J]. The Lancet Oncology, 2012, 13(1): 25-32. https://doi.org/10.1016/S1470-2045(11)70336-9
9.Howington J A, Blum M G, Chang A C, et al. Treatment of stage I and II non-small cell lung cancer: Diagnosis and management of lung cancer: American College of Chest Physicians evidence-based clinical practice guidelines[J]. Chest, 2013, 143(5): e278S-e313S. https://doi.org/10.1378/chest.12-2359
10.Forde P M, Chaft J E, Smith K N, et al. Neoadjuvant PD-1 blockade in resectable lung cancer[J]. New England Journal of Medicine, 2018, 378(21): 1976-1986. doi: 10.1056/NEJMc1808251.
11.Provencio-Pulla M, Nadal-Alforja E, Cobo M, et al. Neoadjuvant chemo/immunotherapy for the treatment of stages IIIA resectable non-small cell lung cancer (NSCLC): A phase II multicenter exploratory study—NADIM study-SLCG[J]. Journal of Clinical Oncology, 2018, 36, 8521. DOI: 10.1200/JCO.2018.36.15_suppl.8521
12.Rusch V W, Chaft J E, Johnson B, et al. Neoadjuvant atezolizumab in resectable non-small cell lung cancer (NSCLC): Initial results from a multicenter study (LCMC3)[J]. Journal of Clinical Oncology, 2018, 36, 8541. DOI: 10.1200/JCO.2018.36.15_suppl.8541
13.Shu C A, Grigg C, Chiuzan C, et al. Neoadjuvant atezolizumab+ chemotherapy in resectable non-small cell lung cancer (NSCLC)[J]. Journal of Clinical Oncology, 2018, 36, 8532. DOI: 10.1200/JCO.2018.36.15_suppl.8532
14.Ben Nun A, Golan N, Ofek E, et al. 1360P Neoadjuvant pembrolizumab (Pembro) for early stage non-small cell lung cancer (NSCLC): Initial report of a phase I study, MK3475-223[J]. Annals of Oncology, 2018, 29(suppl_8): mdy290. 011. https://doi.org/10.1093/annonc/mdy290.011
15.Cascone T, William W N, Weissferdt A, et al. LBA49 Neoadjuvant nivolumab (N) or nivolumab plus ipilimumab (NI) for resectable non-small cell lung cancer (NSCLC)[J]. Annals of Oncology, 2018, 29(suppl_8): mdy424. 059. https://doi.org/10.1093/annonc/mdy424.059
16.Robert C. Is earlier better for melanoma checkpoint blockade?[J]. Nature Medicine, 2018, 24(11): 1645-1648. https://doi.org/10.1038/s41591-018-0250-0
