来源:
Journal of Neurosurgery 杂志 2019年3月22日在线发表上海仁济医院Cao H,美国Xiao Z、Zhang Y等联合撰写的临床研究《不同大分割立体定向放射治疗技术治疗最长直径超过3厘米的颅内肿瘤。Dosimetric comparisons of different hypofractionated stereotactic radiotherapy techniques in treating intracranial tumors > 3 cm in longest diameter.》( doi: 10.3171/2018.12.JNS181578. )

作者研究的目的旨在探索比较通过以下治疗平台治疗:Icon型伽玛刀(GammaKnife,GK) ,射波刀 (CyberKnife,CK) G4,瓦里安TrueBeam STx容积旋转调强放射治疗(volumetric modulated arc therapy,VMAT),Mevion S250双散射质子治疗(double scattering proton therapy,DSPT),以及瓦里安ProBeam调强质子治疗(intensity modulated proton therapy。IMPT)进行大分割立体定向放射外科治疗大型脑肿瘤的剂量学质量。
作者对接受VMAT治疗的10例大型(最长直径超过3厘米)脑肿瘤患者的立体定向放射治疗方案进行回顾性分析。使用相同的约束条件,使用下列放射外科方法,为每个患者产生6个治疗方案,按20-30Gy,5次分割:1)伽玛刀GK, 2)射波刀 CK, 3)共面旋转(coplanar arc)VMAT (VMAT-C), 4)非共面旋转VMAT (VMAT-NC), 5) DSPT(双散射质子治疗), 6) IMPT(调强质子治疗)。在所有设备平台上对覆盖率(coverage);适形性指数(conformity index);梯度指数(GI);均质性指数(homogeneity index);危及器官的平均和最大点剂量(mean and maximum point dose of organs at risk);正常脑受照2 Gy (V2)、5 Gy (V5)、12 Gy (V12)的总体剂量体积(V);以及整体受照剂量(integral dose)进行比较。
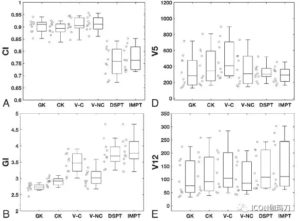
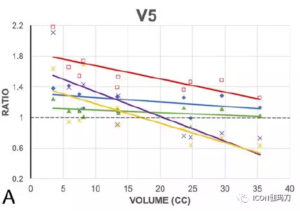
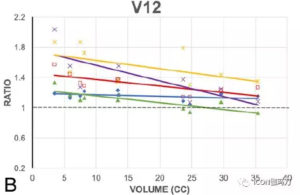
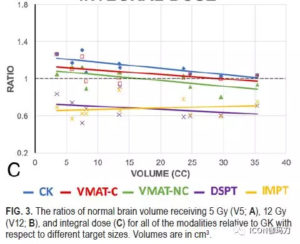
作者发现,在6种技术中,即便有更高的靶区中心剂量,伽玛刀(GK)始终产生更剧烈的剂量衰减。伽玛刀(GK)组的梯度指数(GI)最低,平均2.7±0.1,其次为射波刀CK(2.9±0.1)、VMAT-NC(3.1±0.3)、VMAT-C (3.5±0.3)。质子束治疗的梯度指数(GIs)平均值最高,DSPT为3.8±0.4,IMPT为3.9±0.4。治疗相对较小的-到中等大小的病变(小于15-20 cm3)时,照射5至12Gy,伽玛刀(GK)治疗中靶区正常脑体积一贯的最低。然而,随着靶区体积增大,与伽玛刀相关的6种模式之间的差异也在减少。特别是,当靶区体积超过15-20立方厘米,质子治疗,正常大脑的(受照5Gy的总体体积)V5最低,从而无论靶区大小,产生正常大脑最低的受照整体剂量。
本研究对在最先进的立体定向放射治疗平台上的光子和质子的剂量学提供了一个深入的认识 。
辐射照射技术的以及图像引导最新进展现在能让更高的消融剂量能以安全的、适形的,准确的方式,实施更短的分割方案。已经研发的几种设备用于实施具体治疗,包括伽玛刀(GK;Elekta),直线加速器(LINACs),射波刀(CK;Accuray),和质子治疗。在所有这些技术中,伽玛刀(GK)被认为是治疗小型(直径< 2-3厘米)脑内病变的黄金标准。然而,对于较大的肿瘤,单次分割中带来的高毒性反应可增加放射性坏死导致神经系统疾病的风险,远远超过局部控制的获益。对于较大的病变,手术切除是另一种选择,关于个人的医疗病案和状况而定,这方面的选择并不总是可行的。使用分割立体定向放射治疗(SRT)治疗相当大的颅内病变已被证明是有利的。除了降低对正常脑组织的毒性反应,SRT治疗中分割之间的细胞周期的再氧化和再分布,增加了乏氧肿瘤细胞的和在一个反应较慢的细胞周期中的细胞的放射敏感性。从安全性和可行性的优势方面来看,发现与单次分割的立体定向放射外科()SRS)治疗相比,分割SRT治疗的有症状的脑水肿发生率较低。
通常,SRT是通过基于LINAC的基于锥形束的(conebased)或多叶光栅(MLC)控制实施照射的。最近的发展,如容积旋转调强治疗(VMAT),通过多个弧旋转使其可行性地应用于治疗大的或多个脑病变。另一方面,射波刀(CK)使用机器人臂和空间跟踪靶区的无框架图像引导技术。最新的Icon型伽玛刀(GK),基于面具的非侵袭性治疗能够使用机载锥形束CT (CBCT)开展治疗,现在使用伽玛刀也能开展分割治疗。此外,质子束治疗,是质子在布拉格峰(Bragg peak)几乎失去了所有的电离能(ionization energies)的一种方法,提供远端以外的最小能量(deliver minimum energies beyond the distal end),可针对特定的区域和深度治疗大的或复杂的颅内型肿瘤。
病人的选择
这项回顾性研究得到了医疗机构伦理审查委员会的批准。从2016年11月到2017年3月,共有10例有单个颅内肿瘤(最长直径>3cm)的患者被选择接受采用瓦里安TrueBeamVMAT技术的分割SRT治疗。对患者特点的研究见表1。处方剂量范围为20至30Gy,分5次分割。大体肿瘤体积(GTV)是由经验丰富的放射肿瘤学医生根据定位CT图像融合磁共振的信息来决定。考虑到摆位的不确定性或分割治疗中的移动,增加2毫米的边缘扩展(margin)来创建计划靶区体积(PTV)。
采用PTV进行方案评价。中位GTV为13.4 立方厘(范围3.4-35.4 立方厘)。中位PTV为25.8立方厘米(范围8.6-57.8立方厘米)。
治疗计划过程
所有的病人都使用VMAT治疗,然后在这项研究中采用回顾性方法制定使用如下其他技术的治疗计划:1)GK, 2) CK, 3) VMAT-C, 4) VMATNC,5) DSPT和6)IMPT。所有病人的图像和器官轮廓勾画被传输到每个单独的计划工作站。总共为每个病人创建了6个计划。治疗方案是由不知晓其他模式的治疗过程的经验丰富的计划师分别为每一种治疗模式制定的,例如,DSPT计划师对IMPT、GK、CK和VMAT技术的计划过程并不知晓。一旦计划完成,制定的计划就会被传输回瓦里安Eclipse V11进行多方案比较。
伽玛刀(GK)计划是在伽玛刀(GK)Icon系统上使用GammaPlan V11创建的。在这种方法中,每个靶点都是通过8扇区上4、8和16毫米的准直器的开启和阻挡进行塑形。预先制定计划以达到下列目标,其中包括最低PTV覆盖率为0.99及梯度指数(GI)小于3。梯度指数(GI)定义为受照一半处方等剂量的体积与受照处方剂量的比值。根据我们以前使用Icon型伽玛刀(GK)的经验,计划的每次分割射线束开启照射时间(beam-on time)低于45分钟,对于面罩患者更能耐受。这样,计划的射线束照射时间限制在每次分割45分钟。一般来说,每个病例要用10-20分钟进行提前计划。。
射波刀和Vmat和质子束部分(略)。
结果
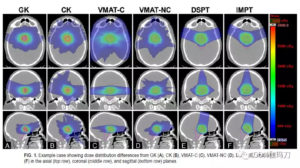
讨论
本研究比较了在各种平台,包括Icon型伽玛刀(GammaKnife,GK) ,射波刀 (CyberKnife,CK) G4,瓦里安TrueBeam STx容积旋转调强放射治疗(volumetric modulated arc therapy,VMAT),Mevion S250双散射质子治疗(double scattering proton therapy,DSPT),以及瓦里安ProBeam调强质子治疗(intensity modulated proton therapy。IMPT),进行大分割放射外科治疗大型脑肿瘤的剂量学性质。在这些技术中,伽玛刀(GK)在肿瘤区域外产生了最陡峭的剂量衰减,梯度指数GI最低,而质子治疗的均质指数(HI)最好。当相对较小的病变被治疗时,照射5至12 Gy,伽玛刀(GK)一贯地靶区正常脑容量最低(consistently targeted the lowest normal brain volume)。然而,相对于伽玛刀(GK),6种模式之间的差异随着靶体积的增大而减小。特别是,当靶体积超过15-20 cm3时,对正常脑的照射5Gy的体积(V5)中质子治疗的最小,同时也产生了正常大脑受照最低的整体剂量。总的来说,就我们所知,这是第一个报告对在最先进的SRT设备平台之间包括光子和质子方法治疗相当大的颅内肿瘤的剂量差异的量化。尽管有这些统计差异,临床相关性和这些差异的影响仍有待确定。
尽管这些SRT仪器的精度很高,出于对固定在病人头部的侵袭性金属框架的实际考虑,对大型病变的治疗过去常常受到限制,这是以前所有的伽玛刀系统的特征之一。与最新的Icon型,是具有使用无框架固定的机载图像引导的功能的伽玛刀(GK)系统,使用伽玛刀(GK)进行大分割治疗现在已具备了可能性。一项比较伽玛刀(GK)和扇形束(fan beam)IMRT治疗的早期研究中发现对中等大小(2-4 cm)的靶区,伽玛刀能产生明显的急剧的剂量衰减(significantly sharper dose falloff),导致额外的保护正常的脑组织。最近的一篇Dong等发表的另一项研究中,将伽玛刀(GK)与基于LINAC治疗1.9- 24.8 cm3(平均10 cm3)的病灶进行比较,得出结论,使用伽玛刀能较好地保护正常组织。然而,关于制止和多次分割的质子SRT治疗相当大的病变所发表的研究报道很少。的确,质子SRT由于其产生的与光子LINAC或钴-60系统不同的剂量分布,具有较高的临床应用价值。我们的一些发现与之前的论文一致,可以断言伽玛刀(GK)在靶区外区域提供了最急剧的剂量衰减。这种快速的衰减是由于物理设计上的原因,允许成千的非共面射线集中于单个靶区。射波刀(CK)通常使用非等心射线大约100-300个方向,而LINAC直线加速器由一到多个弧形射线束组成。多射束角(multibeam angle)的优势是显而易见的,因为伽玛刀的梯度指数(GI)是最低的,
紧随其后的是射波刀(CK),然后是非共面的和共面的VMAT。质子治疗,典型的是2-3条射束,显示梯度指数GI最差。除了射线束的数目,由于机械的物理设计,质子束的横向物理半影变得更加扁平。名义上的源轴距(SAD),Mevion质子机是在200cm,相比之下,LINAC的为100cm,射波刀 CK为80cm,伽玛刀 GK为50cm。另一个重要的导致DSPT梯度指数较低的因素是需要考虑质子计划范围不确定性。由于CT Hounsfield单位(HU,CT 值)转换到质子停止加速器产生出的质子束的功率和能量范围的不确定性,在质子束治疗的治疗规划过程中,有必要特别考虑范围的不确定性。。所有这些因素都导致了与光子治疗相关的较低的梯度指数GI。然而,应该指出的是,沿射线束方向质子治疗具有潜在的剂量学优势。质子射线束将大部分的剂量储存在一个被调节的狭窄区域内(布拉格峰,Bragg peak),,提供高适形分布,沿光束方向基本上无出口剂量,从而降低整体正常组织剂量。如果质子束仅用于靶区剂量覆盖适形性,多个质子束可以从不同的方向对准靶区,潜在的生产更加适形的剂量覆盖。如图2所示,质子治疗产生脑干的最低平均剂量和最低最大点剂量。因此,总的来说,质子优势应该在个案的基础进行评估,而不是一般的V5或V12的方案。
除了机器设计的物理特性外,在对大型的病变进行计划时,应考虑治疗效率。我们分享了第一年使用Icon型伽玛刀进行基于面罩的SRT治疗的经验。在26个无框架分割治疗中,平均计划射线束开启时间(beam-on time)为35.5 +24.2分钟(范围12.2-110.9分钟)(未行源强度的校正),治疗时间为50.0+39.6分钟(范围13.0-202分钟)。病人移动超过预设水平(如1.5毫米)则停止机器,直到病人被重新摆位,从而增加了射线束照射时间。由于在本研究中,事实上,更长的射线束开启时间会触发机器更频繁地停止,直到治疗结束,因此计划的射线束开启时间被限制在45分钟,预计60分钟的治疗时间。相比之下,共面的VMAT通常需要5-10分钟使用1-2个拉弧,以及提供4个非共面拉弧,照射10-20分钟,正常剂量率为1600-2400MU(机器跳数/分钟。为了达到合理的治疗效率,使用较大的准直器(8 – 16mm)进行治疗降低了伽玛刀的剂量优势。这也解释了为什么随着靶区体积的增加,伽玛刀(GK)的剂量差异也会随着降低。
传统上,由于亚毫米靶区精度和头架的最小位移单次分割伽玛刀(GK)治疗无需计划靶区体积(PTV)的边缘扩展(margin)。然而,进行分割治疗时,伽玛刀计划的PTV的概念应该重新考虑。一个典型的PTV边缘扩展的设计包括靶区不确定性(targeting uncertainty)、成像系统不确定性(image system uncertainty),分割治疗时/分割治疗间隔中的移动(intra-/interfractionation motion),和摆位的不确定性(setup uncertainties.)的组合。使用Icon 伽玛刀(GK)进行分割治疗,患者使用无创口罩固定和由红外摄像机跟踪系统监控。我们已经评估了基于头架固定和基于面罩固定的两种治疗的运动误差,并发现显示出明显较大的差异。患者位移达到预设值(默认1.5 mm),治疗自动停止。从理论上讲,这个值可以设置得更小(例如,< 1 mm),以确保更小的分割治疗内的运动,从而产生一个可以忽略的边缘扩展。然而,这种调整可能并不总是如此实用,因为一个紧密度公差可能会增加照射中断的次数。每中断一次,就需要对患者体位摆位进行新的一套CBCT复位,而且该计划需要在实施照射前重新评估。所以每一次,至少5-7分钟,会增加治疗时间。Li等也开发了一种PTV边缘扩展的计算器,使用原型CBCT引导的伽玛刀GK,专门用于多次分割的SRT治疗。通过考虑靶区大小,形状,剂量分布,和测量分割治疗中/分割治疗间隔内的移动,他们建议应增加1- 2毫米的边缘扩展,以确保多次分割伽玛刀GK系统治疗的靶区覆盖率。总的来说,必须考虑到与采取面罩固定有关的移动误差的多变性,需要更多的调查来帮助解决设计适当的规划边缘扩展来补偿涉及使用Icon型伽玛刀(GK)的治疗不确定性。基于LINAC和基于射波刀的以及质子SRT治疗,通常由于靶区精度成像失真畸变,MRI图像与定位CT融合不确定性,摆位的不确定性的组合,经验的各向同性PTV边缘扩展为2 mm。为了实现直接比较,在本研究中的所有模式都使用了1- 2毫米PTV的边缘扩展。然而,应用PTV边缘扩展增加了总体靶体积,这与放射性坏死等毒性反应增加有关。已经报道了一项测量方法作为颅内单次分割SRS治疗后放射性坏死的预测因子,即受照12Gy的体积,除了 2-5次分割的大分割方案,尚无关于确立的指标的报道。因此,用户应该谨慎地决定最佳的PTV边缘扩展进行分割SRT治疗。除PTV边缘扩展外,多次分割的SRT治疗还应强调均质性指数(HI)。尽管支持的临床数据很少,但理论上,在同样的外周剂量下,肿瘤内较高的剂量可以转化增强治疗乏氧性肿瘤的临床疗效。由于基于头架固定下的分割治疗内的移动可忽略不计,甚至可以将均质指数(HI)低考虑为传统上的单次分割的伽玛刀(GK)治疗的优势。然而,对于接受分割治疗的患者,剂量均匀性可能是关键性的,因为分割治疗中和分割治疗间的不确定性或移位,当热点发生在附近的敏感区域,可能会造成严重的副作用。如果关键器官临近分割SRT治疗的靶区,则应谨慎设计未来的计划研究。
另一个要考虑的因素是计划目标是靶区覆盖率。在目前的研究中,在不同的平台上计划靶区体积PTV的覆盖率的范围从95%到99%。在我们的临床实践中,要求用于伽玛刀(GK)的计划覆盖率最低为99%,光子或质子治疗的一般覆盖率最低为95%。为了达到直接比较,所有的计划都被重整为相同的PTV覆盖率。这可以通过改变处方等剂量线来实现。例如,最初的GK计划处方50%等剂量线,以确保99%的覆盖率,可以调整为52%的等剂量线95%的肿瘤覆盖率。这一调整将使重整的伽玛刀GK计划的总剂量降低几个百分点。重整化对除伽玛刀GK以外的计划的影响要小一点,因为计划的目标是达到最小的95%的覆盖率。在临床情况下,虽然靶区覆盖率存在变化,不同平台上的剂量学参数与靶区体积相对的总体趋势将保持不变。
本研究存在一些局限性。作为一个回顾性研究,患者都未随机分组,会导致潜在的选择偏倚。此外,本研究只关注剂量测定的比较。而生物学上的影响则不在这里讨论。辐射剂量率的影响也没有纳入到本研究,不同的治疗平台具有相当不同的最大施照率(maximum delivery rates)。光子和质子的物理性质和与物质的相互作用是不同的,导致在组织RBE(相对生物效应)的变化。在最后几毫米范围内,线性能量转移增加,导致用质子束法的RBE(相对生物效应)增加。在质子SRT治疗中,一般假设的RBE为1.1仍然有效,值得进一步研究。此外,从伽玛刀的Co-60源(约300 cGy/秒)的相对较低剂量的生物效应与基于LINAC的VMAT的非均整模式(FFF)射线束(1400-2400 cGy/秒)的照射进行比较,可能会造成不同的效果。尽管缺乏对非均整模式(FFF)射线束的对照研究,但有几篇文章讨论了高剂量率照射的放射生物学问题,特别是每次分割的大剂量照射。有结果表明,在一定条件下由于分割时间增加晚反应组织的生物有效剂量(BED)降低会明显大于肿瘤的生物有效剂量(BED)的降低。这种效果,虽然超出了目前研究的范围,应在今后的工作中加以考虑。最后,设计本研究旨在评估不同SRT平台之间的剂量学差异。它提供了对一种技术优于另一种技术的了解的基线。需要未来的研究确定剂量学参数如何影响临床结果。在选择最合适的多次分割SRT放射治疗方法之前,必须对剂量学和临床因素进行全面评估。
结论
总的来说,这项研究为大分割立体定向放射治疗(SRT)提供了有用的剂量学观察见解。质子SRT可以代表替代性光子SRT治疗大的且不规则形状的接近敏感结构的肿瘤,但这应该在具体个案的基础上进行评估。治疗小到中等大小的病变时,相比任何其他的方法,仍然是伽玛刀(GK),对正常大脑所产生的剂量是最低的。然而,这种优势随着肿瘤大小增加而下降。此外,在制定适形计划时,增加射线束数目或非共面弧是有益的,也要考虑到治疗效果(treatment efficiency)。了解所有可用治疗方法的剂量测定的优缺点仅仅是选择最佳用于大的脑肿瘤患者的大分割放射治疗方案的第一步。需要回答有关治疗上的有趣问题,比如在分割方案下,如何更准确地靶向病灶,什么是不同的分割等效的V12,什么是最好的剂量和分割实施方案,或如何提供多弧的质子射束以提供更适形的计划,并保在研究领域持活跃。
