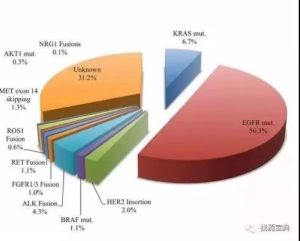
靶向治疗是医疗带给肺癌患者一大福音,有着高效低毒的优点。近几年,肺癌靶向治疗发展神速,已经提升至九大靶点的研究。近期刚落幕的AACR及ELCC会议也报出了众多靶向新进展。今天,小编呕心汇总肺癌九大基因靶向治疗及临床用药序贯选择,供初治及耐药的患者参考。
—EGFR突变—
1.一线治疗:多种TKI可选,联合治疗带来新突破
②TKI联合治疗:
这是目前为了提升疗效而展开的研发趋势,已获得阳性结果的III期试验有1代联合贝伐单抗或化疗。联合治疗疗效明显优于单药,但是无可避免不良反应显著增加及经济负担加重的问题,因此是否一线直接使用联合治疗,仍需多因素综合判断,谨慎选择,况且目前联合治疗后的耐药机制研究也比较少,耐药后如何有效处理也是疑点。
③罕见突变:
对于EGFR罕见突变,可以选择奥希替尼(ORR50%)或阿法替尼(ORR75%)治疗。
波奇替尼一项Ⅱ期研究中,招募了11例EGFR 20ins的肺癌患者,最终ORR达到64%。
TAK-788在18例EGFR 20ins患者中有1例达到CR,6达到PR(3例待确认),6例SD,ORR为39%,DCR为94%,4名已确认有效的患者中位DoR超过222天,其中3名仍在临床组中。
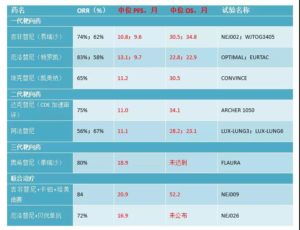
下表为EGFR突变不同一线治疗方案(单药及联合)的3期研究疗效
2.二线及以后治疗:不同的一线用药引导不同的后线治疗,可选方案虽多,化疗地位仍不容小觑
③耐药后出现MET扩增,可以用沃利替尼联合奥希替尼治疗。最新数据在今天AACR会上公布。
该1b期试验分为两个队列:1/2代EGFR-TKI进展后T790M阴性MET扩增;三代TKI进展后MET扩增阳性患者。队列一ORR(客观有效率)为52%,DCR(疾病控制率)达到87%。DOR(反应持续时间)为7.1个月。
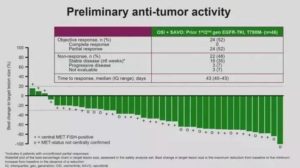
队列二ORR为25%,DCR为69%,DOR为9.7个月。无论是一/二代TKI耐药,或是三代耐药,DCR都能稳定在69%以上。
另一项研究显示,吉非替尼联合INC280治疗MET+的ORR为29%,DCR为73%。此外,还有奥希替尼联合卡博替尼/克唑替尼的个案报道进行佐证。
④无论是一线或二线使用奥希替尼,耐药后建议做基因检测,以查明耐药性突变类型。C797S单突变(见于奥希替尼一线用),可用一代TKI;C797S顺式突变,可用布加替尼+西妥昔单抗;C797S反式突变,可用一代EGFRTKI+奥希替尼。出现其他继发突变(如BRAF、HER2、RET等),可以用奥希替尼联合相应靶向药。

对于奥希替尼耐药后处理,可以参见:2019奥希替尼耐药处理方案最全汇总
⑤转归化疗:
对于耐药机制不明或发生小细胞肺癌转化的患者,还是建议转归化疗。对于EGFR突变患者,PD1治疗并不做推荐,传统化疗仍有一定的治疗地位。而且,化疗一段时间后,耐药细胞群被杀灭,也有可能出现再次对靶向药敏感的情况。
⑥TKI再挑战:
在TKI耐药后,穿插化疗或其他方案后,可以尝试再使用EGFR-TKI。TKI再挑战目前尚无统一用法,吴一龙教授的CTONG1304已经取得首个前瞻性研究结果。另外,多个回顾性研究也说明TKI再挑战适用于各代TKI(从1代-3代),并且在后线挽救治疗有时可以达到逆转乾坤的惊喜。
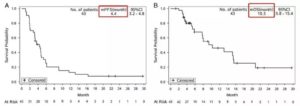
奥希替尼再挑战首个研究结果公布:控制率73%,成功逆转多线耐药治疗难题
⑦新靶点新药:多种针对EGFR-TKI耐药后的药物及方案正展开研究。
EGFRTKI+依维莫司(mTOR抑制剂)达到83.3%DCR。
吉非替尼联合AXL抑制剂S49076,14例患者有4例达到6个月无进展存活。
厄洛替尼联合Bemcentinib,DCR33%。
奥希替尼联合极光激酶抑制剂,AZ7608联合爱必妥两种方案都取得临床前研究结果。
EGFR新药较多,治疗可选方案也很多,每个方案所引导出的耐药后肿瘤细胞特性及应对方法也各有不同,临床上尚无最佳的推荐路线,仍需逐步琢磨。对于EGFR突变患者,总体治疗原则可以参照一以下图表循行渐进,并灵活的结合自身情况,选择最佳的用药方案。
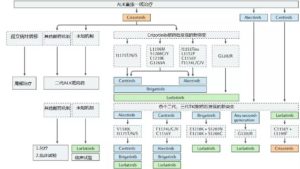
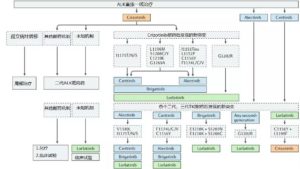
—ALK重排/融合—
1. ALK-TKI介绍
2019年ELCC会上报道了布加替尼vs克唑替尼的ALTA-1L一线研究数据更新。结果显示,布加替尼的中位PFS明显优于克唑替尼,为未达到vs9.8个月,1年PFS率也更高(67% vs 43%)。中位DOR(反应持续时间)为未达到vs11.1个月。颅内疗效方面,对于有可测量脑转移灶患者,布加替尼ORR完胜克唑替尼(78% vs 29%),并且有11%达到了CR,而克唑替尼无CR。所有脑转的ORR方面亦是布加替尼更优,为67% vs 17%,CR率为37% vs 4%。
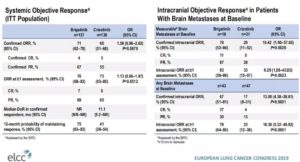
颅内PFS,布加替尼显著延长,为未达到vs5.6m。布加替尼不仅对脑转有效,对脑转还具有一定的预防作用:在初治患者中,布加替尼组的6个月及12个月脑转移累计发生率更低(4% vs 15.5%,12% vs 22.6%)。
阿来替尼、色瑞替尼和布加替尼已被FDA批准用于一线及克唑替尼耐药后的二线治疗。基于ALEX研究的艾乐替尼一线治疗中位PFS达到25个月,获得NCCN指南优先推荐用于一线治疗。其中在二线用药时,布加替尼的数据最佳。
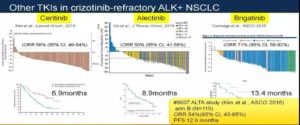
在脑转移控制上,阿来替尼的疗效最佳。
第三代TKI:2017年10月17日,在WCLC2017大会上公布了Lorlatinib(劳拉替尼)的Ⅱ期临床试验完整数据(见下表)。表中可见,劳拉替尼不仅对ALK突变有很好的疗效,颅内ORR也非常可观。
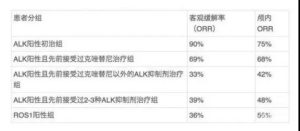
2.一线方案:指南推荐阿来替尼作为首选,获益最大
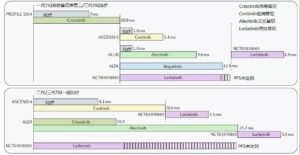
3.二线及以后方案:勤找耐药机制,灵活切换靶向药;布加、劳拉替尼可以保底
 另外,2019年ELCC会上报道了布加替尼在后线使用的疗效,发现了布加替尼也可作为后线挽救治疗。对于既往使用过1代、2代,甚至劳拉替尼的患者,耐药后再尝试布加替尼,仍然可以取得满意的持续用药时间。布加替尼潜力可期。
另外,2019年ELCC会上报道了布加替尼在后线使用的疗效,发现了布加替尼也可作为后线挽救治疗。对于既往使用过1代、2代,甚至劳拉替尼的患者,耐药后再尝试布加替尼,仍然可以取得满意的持续用药时间。布加替尼潜力可期。
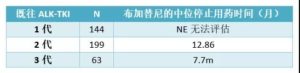
—ROS1突变—
1.ROS1靶向药
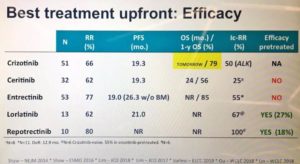 另外,还有DS-6051b这个新药,初治ORR为62.5%,用于克唑耐药后治疗ORR为30%。
另外,还有DS-6051b这个新药,初治ORR为62.5%,用于克唑耐药后治疗ORR为30%。
①克唑替尼:
试验纳入ROS1阳性的晚期NSCLC患者,大部分患者为经治,共分析了53例患者。
中位OS达到了51.4个月,4年OS率为51%,这意味着半数以上患者用一代ALK-TKI治疗活过了4年以上,堪称肺癌一大突破。另外,ORR为71.7%,DCR更是高达90.6%!中位DOR达到了24.7个月。中位PFS为19.3个月。
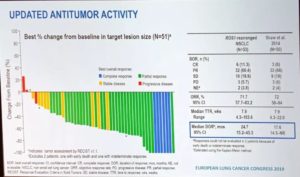
②色瑞替尼:
2017年5月份,JCO发布了色瑞替尼针对ROS1融合患者的二期临床数据,该试验共纳入32位初诊的ROS1融合的非小细胞肺癌患者,包括8位有脑转移的患者。有效率高达62%。值得一提的是,对于有脑转移的ROS1融合患者,色瑞替尼的控制率达到63%。
③劳拉替尼:
2018 WCLC报道了Lorlatinib治疗ROS1阳性NSCLC的Ⅱ期临床研究结果。未接受克唑替尼治疗的ROS1+患者,接受劳拉替尼治疗后,ORR为61.5%,1例患者CR,7例患者PR,中位PFS为21个月。
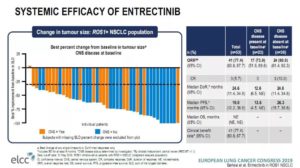
④Entrectinib (RXDX-101):
2019ELCC会上报道了恩曲替尼疗效。共分析了ALKA-372-001,STARTRK-1及STARTRK-2三项研究中ROS1阳性未经靶向治疗的晚期NSCLC患者,一共53例患者。
结果显示,恩曲替尼的ORR达到了77.4%,其中有3例达到了CR,展现了强效靶向药的硬实力。另外,中位PFS达到了19个月,DOR达到ROS-TKI史上最长——25个月!
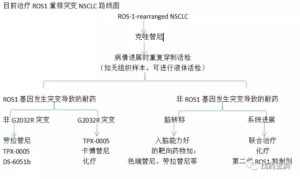
2.克唑替尼耐药处理
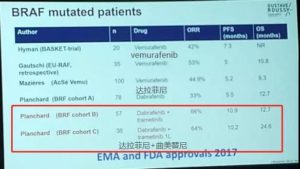
—BRAF基因突变—
—NTRK融合—

最新肺癌数据:TRK-14001及NAVIGATE两项篮子研究一共分析了7例TRK融合阳性的NSCLC患者。ORR达到71%,其中一例达到CR(完全缓解)。中位起效时间为1.8个月,中位DOR(反应持续时间)未达到,范围是7.4-17.6个月。
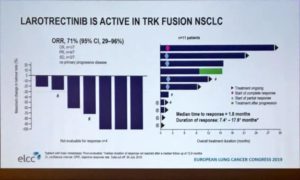
对于颅内ORR,目前尚无法评估。不过大会上报道了一例女性70多岁的脑转疗效。该患者有多发无症状脑转移,经过拉罗替尼治疗后,该患者的颅内病灶减小了95%,几乎完全消失。结果初步证实了拉罗替尼入脑疗效。
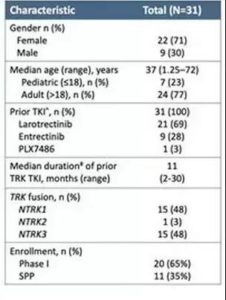
二代NTRK靶向药:大会公布了新一代TRK抑制剂LOXO-195在早期临床试验中的结果。LOXO-195能够抑制对TRK抑制剂产生抗性的TRK蛋白的活性。该试验纳入了TRK靶向药Loratrectinib、Entrectinib耐药后的实体瘤患者,其中70%既往接受过larotrectinib治疗。结果表明,整体ORR 34%(10/29),其中有TRK突变的20例患者中ORR 45%(9/20)。
—MET基因异常—
3.MET蛋白过表达:在肺腺癌中发生率高达65%,为其他基因激活后的二次事件。
目前作为NSCLC靶向治疗的MET基因异常包括MET14外显子跳跃及MET扩增,均可用MET抑制剂。MET-TKI根据结合特点不同,又分为Ia型、Ib型、II型及III型四种,其中III型TKI未用于肿瘤试验。
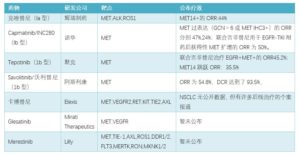
①沃利替尼:
今年AACR上,陆舜教授主持了国产TKI沃利替尼(savolitinib)单药的II期研究报道。该试验纳入了31例MET14跳跃缺失突变的肺肉瘤样癌(PSC)及其他种类的晚期NSCLC患者,41.5%的患者为初治,19.5%的患者基线有脑转移。按RECIST1.1结果评估,ORR为54.8%,DCR达到了93.5%之高,控制率极强。中位PFS还未成熟。
②克唑替尼:
2016ASCO大会报告了RROFILE 1001研究结果,在伴有MET基因14外显子变异的肺癌中,克唑替尼具有临床意义的抗肿瘤活性,总体有效率为44%,50%呈现疾病稳定,疾病控制率100%!
③卡博替尼:
卡博替尼是一种口服的多靶点的小分子酪氨酸激酶抑制剂,可以抑制RET、MET、ROS1、VEGFR-1/2/3、KIT、TRKB、FLT-3、AXL和TIE-2等蛋白的酪氨酸激酶活性。在一项II期临床试验中,卡博替尼联合厄洛替尼治疗TKI靶向治疗后疾病进展的EGFR阳性的晚期NSCLC患者,疾病控制率为DCR67.6%。
④Capmatinib:
2016年ASCO大会上吴一龙教授报导了NCT01610336试验的 I 期临床结果,采用Capmatinib 400mg bid联合吉非替尼 250mg qd治疗EGFR突变的cMET+的NSCLC患者,有效率ORR为31%,疾病控制率DCR为81%。
⑤Tepotinib:
2018ASCO上Tepotinib公布的数据也非常积极。并且其临床设计也非常前卫。在组织检测的同时,设立了一组液体活检临床实验臂。在组织检测组,26个患者有11个应答,ORR为42.3%。液体活检组,16个患者中,9个应答,ORR 达到56.3%。组织检测与液体活检均为阳性的患者比例为77%,在这28名患者中,12名应答,应答率为42.9%。
⑤Onartuzumab:
由基因泰克(Roche子公司)研发,于2011年由Roche授权于日本中外制药株式会社用于NSCLC的研发。一项试验结果表明,MET高表达的肺癌患者接受Onartuzumab联合厄洛替尼治疗后,OS为12.6个月,PFS为2.9个月。
⑥Rilotumumab:
一项研究,45名其他治疗失败的晚期肺癌患者,2人有EGFR突变,33人明确是EGFR野生型,8人有KRAS突变。接受rilotumumab联合特罗凯治疗,疾病控制率为60%,中位生存期为6.6个月:其中EGFR野生型的患者,疾病控制率也有60.6%,中位生存期为7.0个月。
①阿法替尼及曲妥珠单抗:
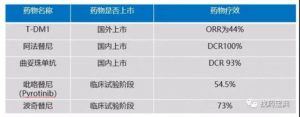
2013年JCO的一项混合型临床试验,在试验中,针对经既往化疗失败的HER2突变患者采用各种HER2的靶向药物治疗。其中只有基于曲妥珠单抗的化疗(DCR 93%)及阿法替尼治疗(DCR100%)的患者出现了疗效。
②T-DM1:
T-DM1(ado-trastuzumab-emtansine)是一种新型抗体药物,由曲妥珠单抗和小分子微管抑制剂DM1偶联而成,产生协同抗癌作用。最先应用于HER2+的乳腺癌,在赫赛汀为基础的治疗失败后国外将T-DM1作为二线首选,但是该药在国内尚未上市知名度不高。而在2017年ASCO大会中报道了该药用在HER2蛋白扩增(IHC 3+)或HER2突变的两个临床试验的阳性结果。其中采用T-DM1治疗HER2突变的非小细胞肺癌试验中,有效率ORR为44%,PFS为4个月。
③波奇替尼:
波奇替尼是近几年新起的针对EGFR与HER220外显子插入突变的良药。早在2017年WCLC上就公布了波奇替尼治疗EGFR 20外显子突变的肺癌患者,有效率可达到73%。
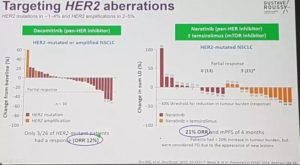
④今年ELCC大会上报道了HER2突变/扩增的靶向治疗数据,包括泛HER2抑制剂达克替尼(dacomitinib),以及泛HER2抑制剂neratinib±mTOR抑制剂temsirolimus的结果。达克替尼单药的ORR为12%。neratinib联合temsirolimus的ORR为21%,中位PFS为4个月。
—RET基因突变—
 ①凡德他尼:
①凡德他尼:
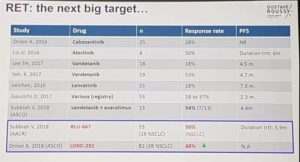
在日本进行的一项多中心的2期临床试验(LURET),纳入符合条件的17例RET融合的患者,31%为CCDC6-RET阳性,53%为KIF5B-RET融合,16%未知的RET状态。患者每天连续口服凡德他尼300 mg(每天一次)。客观缓解率ORR为53%。
②卡博替尼:
治疗RET融合ORR为38%
③乐伐替尼:
2016年ESMO年会公布了乐伐替尼对RET融合的非小肺癌的临床数据,招募25名RET融合的患者接受24mg每天的7080治疗,4名患者的肿瘤缩小,有效率16%;不过15名患者的肿瘤稳定不进展,控制率76%。
④LOXO-292:
2018ASCO报道LOXO-292在不考虑RET融合对象的情况下,显示出了较高的ORR。对于KIF5B-RET基因融合NSCLC患者,LOXO-292可以实现81%的客观应答(肿瘤缩小30%以上),对于非KIF5B-RET基因融合NSCLC患者,ORR为82%。
⑤BLU-667:
2018AACR公布的数据显示,19例之前接受过不同方案治疗的RET基因融合患者接受BLU-667治疗,中位治疗时间3.9个月(0.4~11.4个月),有14例患者的临床数据可评价,其中完全缓解0例,部分缓解7例,疾病稳定5例,疾病进展2例,ORR为50%。
⑥RXDX-105:
是Ignyta公司开发的强力RET抑制剂,2017ESMO大会报导了一项试验, 13例KIF5B-RET融合患者的客观有效率是0%,而8例非KIF5B-RET融合患者中客观有效率是75%。显而易见,RXDX-105不具备覆盖KIF5B-RET基因融合的潜力。
—KRAS突变—
2.Abemaciclib:
研究发现,KRAS基因和细胞周期蛋白依赖性激酶4(CDK4)有合成致死效应,所以携载有针对CDK4siRNA的混合胶束颗粒对小鼠进行治疗,显示有显著抑制肿瘤生长的效果。
3.阿法替尼:
近期临床前试验显示阿法替尼通过ERRB2通路抑制KRAS突变引发的致癌活化,有潜在治疗价值。
